
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соль + вода кислота + основание
|
|
|
|
СН3СОO - + NН4+ +Н2О СН3СООН + NН4ОН.
СН3СООNН4 + Н2О СН3СООН + NН4ОН
или в ионном виде:
9. Равновесие гидролиза:
Если гидролиз является обратимым процессом, то его равновесие можно сместить на основе принципа Ле Шателье:
Гидролиз (эндотермический процесс)
Нейтрализация (экзотермический процесс)
Итак, для усиления гидролиза необходимо:
· Раствор разбавить и нагреть.
· Связать один из продуктов гидролиза (ионы H + или ОН –), добавлением к раствору кислоты, щелочи или другой гидролизующейся соли.
Для ослабления гидролиза необходимо:
· Увеличить концентрацию раствора и понизить температуру.
· Добавить к раствору один из продуктов гидролиза.
Разбавление, нагревание, добавление H +
Na2CО3 + Н2О 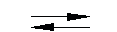 NaHCО3 + NaОН
NaHCО3 + NaОН
CО3 2–+ Н2О 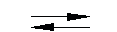 HCО3– + ОН –
HCО3– + ОН –
охлаждение, увеличение концентрации, добавление ОН –
10. ЖЕСТКОСТЬ ВОДЫ, совокупность св-в воды, обусловленная наличием в ней преим. катионов Са2+ (кальциевая жесткость воды) и Mg2+ (магниевая жесткость воды)
Выделяют 2 типа жесткости воды:
- временная – карбонатная жесткость, обусловлена присутствием на ряду с кальцием, магнием и железом гидрокарбонатных анионов;
- постоянная – некарбонатная жесткость, характеризуется присутствием сульфатных, нитратных и хлоридных анионов, соли кальция и магния которых прекрасно растворяются в воде;
- общая жесткость определяется как суммарная величина наличия солей магния и кальция в воде, то есть суммой карбонатной и некарбонатной жесткости.
Жесткость способствует возникновению коррозии металлических и бетонных конструкций. Соли жесткости отлагаются в виде накипи на стенках теплообменного оборудования, снижая эффективность работы вплоть до аварий.
Методы устранения:
· Физический
· Химический
· Ионно-обменный
1.Нагревание воды до 70-90 градусов
(только соли временной жесткости)
Сa(HCO3)2 = CaCO3 ↓ + H2O + CO2↑
2. А)содовый: CaSO4 + Na2CO3= CaCO3 ↓+ Na2SO4(и та и та)
Б)фосфатный метод: 3MgSO4 + 2Na3PO4 = Mg3(PO4)2↓ + 3Na2SO4(и та и та)
В)известкование: Сa(HCO3)2+ Ca(OH)2 = CaCO3 ↓ +2 H2O(только временная жесткость)
3. Метод ионного обмена, основанный на обмене ионов Са2+ и
Mg2+, содержащихся в воде, на ионы Na 2+ или H + путем пропускания воды
через иониты.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 664; Нарушение авторских прав?; Мы поможем в написании вашей работы!