
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетерогенные системы
|
|
|
|
7.
3.
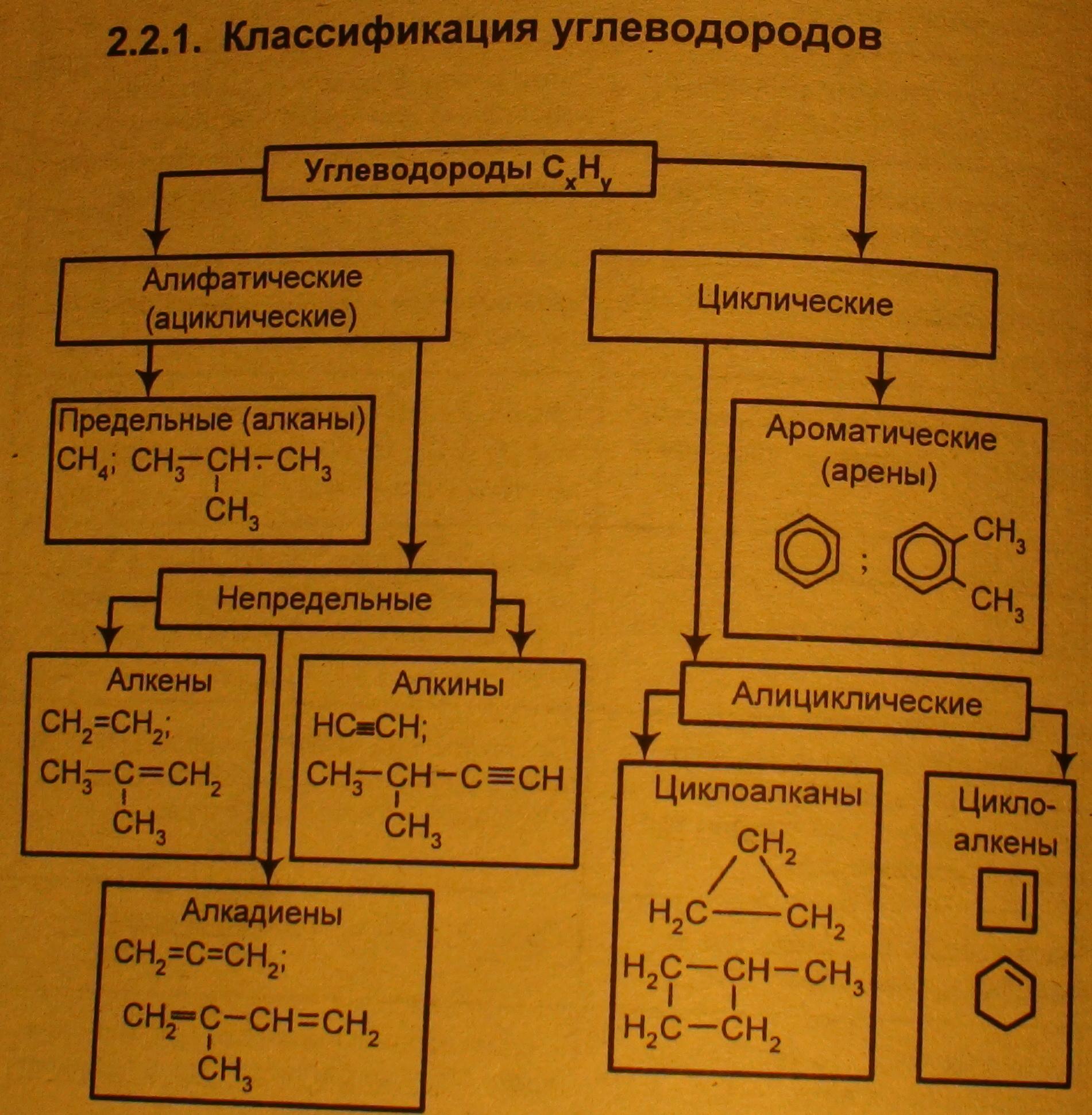
Элементы органической химии
1. Органические вещества, органические соединения — класс соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов)
2. Атомы в молекуле соединены в определённой последовательности в соответствии с их валентностью. Эта последовательность называется химическим строением.
3. Свойства вещества зависят не только от качественного и количественного состава молекулы, но и от её химического строения. Вещества, имеющие один и тот же состав, но разное строение, называются изомерами, а само их существование изомеризацией.
Виды изомерии:
· Структурная
· Пространственная
1.а) по строению углерод. скелета
C4H10
CH3-CH2-CH2-CH3
CH3-CH-CH3
CH3
б) по положению красной связи
C4H8
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
В) по положению заместителя
CH3-CH2-CH2-OH
CH3-CH-CH3
OH
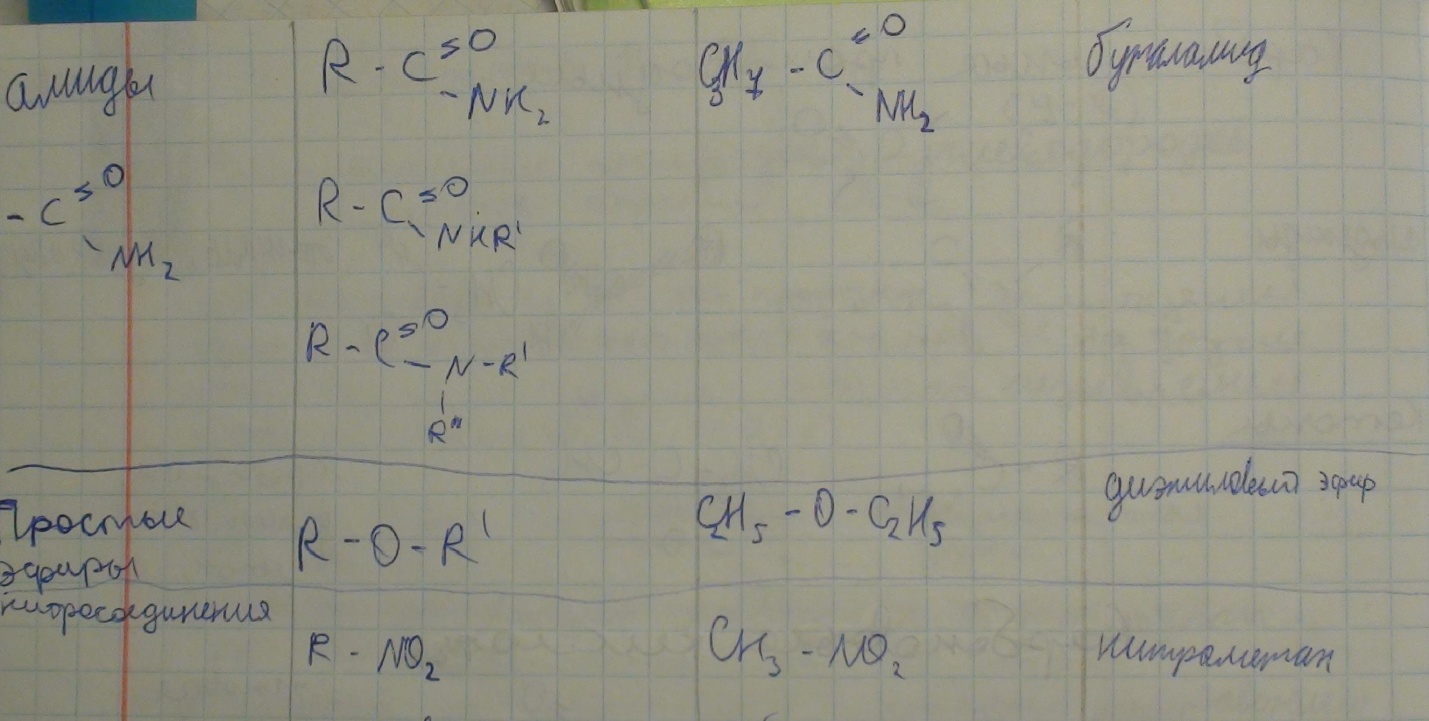
Г) межклассовая изомерия.
CNH2n CnH2 n-2
Алкены циклоалканы алкины алкодиены
Карбоновые кислоты сложные эфиры
Простые эфиры сложные эфиры
2.а) кафорнационная
Б)зеркальная или оптическая изомерия
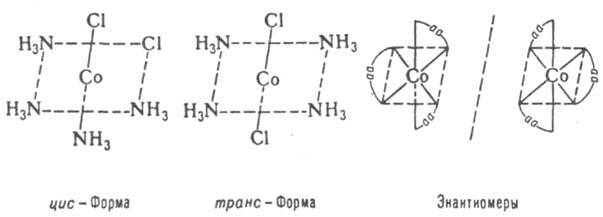
В)геометрическая или цис-транс изомерия. Обязательные условия её существования: наличие 2й связи и плоского цикла, наличие различных заместителей атомов углерода, связанных 2й связью:
CH3 CH3 H CH3
C=C C=C
H H CH3 H
4. 
5. 

6. 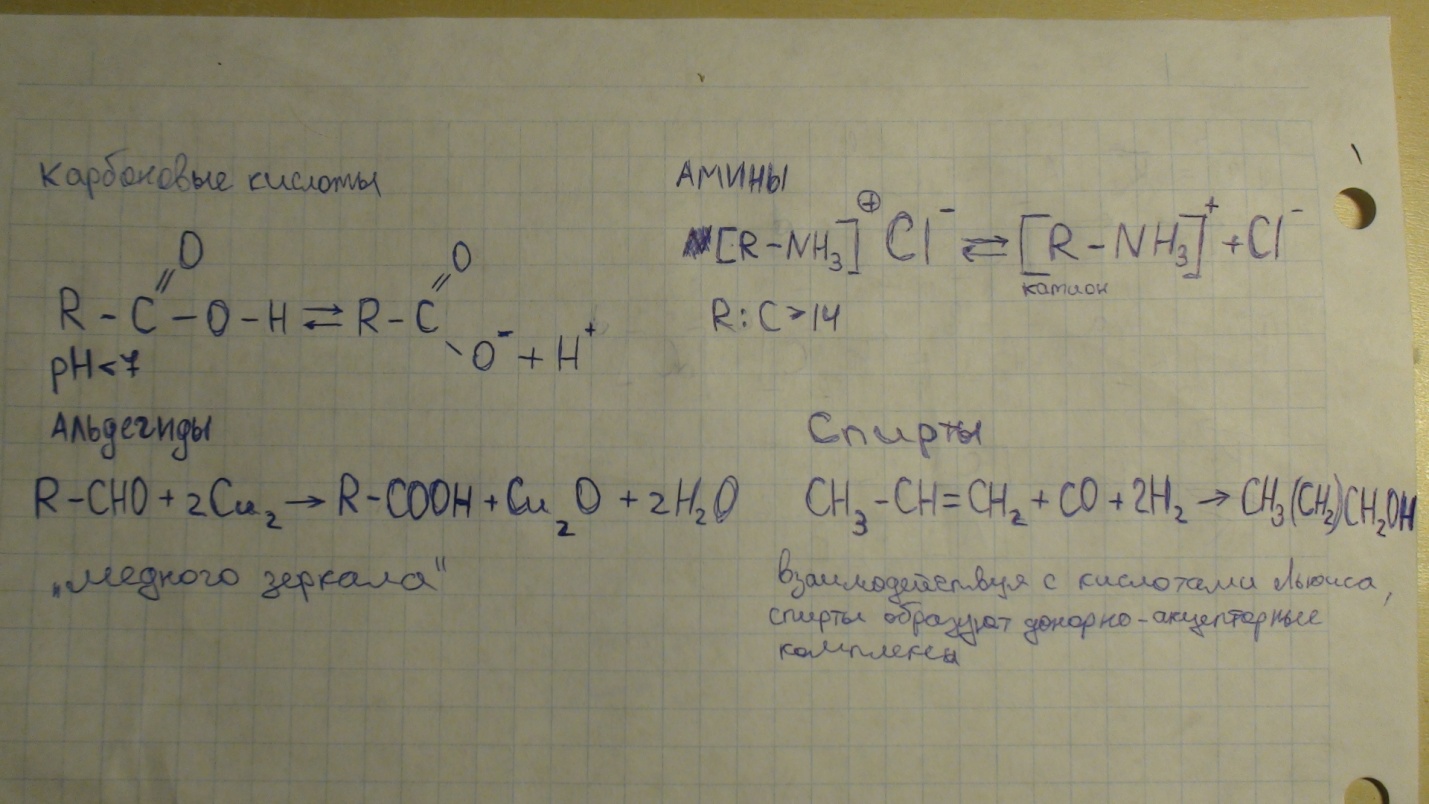
ИЗОМЕРИЯ- существование соединений (гл. обр. органических), одинаковых по составу и мол. массе, но различных по физ. и хим. св-вам. Такие соед. наз. изомерами.
Изомеры углеродной цепи:
CH3-CH2-CH2- CH2- CH3 ß С5H12 -> CH3-CH2- CH2- CH3
|
CH3
Пространственная изомерия:
8. Реакции полимеризации- синтез ВМС из мономеров путем последовательного присоединения молекул непредельных соединений к друг другу без выделения побочного низкомолекулярного продукта;
Полиэтилен (ПП - сокр., PE - Polyethylene англ.) [-CH2-CH2-]n - термопластичный полимер белого цвета, наиболее распространенный при изготовлении канализационных труб материал, характеризующийся очень высокой стойкостью к химическим реагентам и исключительно низкой шероховатостью поверхности, что снижает интенсивность образования отложений и гидравлические потери. Преимуществами являются также высокая стойкость к ударным нагрузкам и высокое относительное удлинение при разрыве при незначительном температурном влиянии.
Полистирол — продукт полимеризации стирола (винилбензола) относится к полимерам класса термопластов.
Имеет химическую формулу вида: [-СН2-СН(С6Н5)-]n-
Широкое применение полистирола (ПС) и пластиков на его основе базируется на его невысокой стоимости, простоте переработки и огромном ассортименте различных марок. Наиболее широкое применение (более 60 % производства полистирольных пластиков) получили ударопрочные полистиролы, представляющие собой сополимеры стирола с бутадиеновым и бутадиен-стирольным каучуком. В настоящее время созданы и другие многочисленные модификации сополимеров стирола.
Полиметилметакрилат(ПММА, PMMA) - это линейный полимер метилметакрилата.
Химическую формулу ПММА можно представить в виде (-CH2-C(CH3)-)n COOCH3.
Применяется в автостроении, машиностроении, авиационной, медицинской промышленностях, строительстве, приборостроении и бытовых изделиях.
Остекление парников, теплиц, куполов, окон, веранд, декоративной отделки зданий, для прозрачных деталей приборов и инструментов, протезов в медицине, линз и призм в оптике, труб в пищевой промышленности, наружная световая реклама, таблички, аквариумы, сувениры, светильники,фары, фонари, детали сантехники, циферблаты часов и приборов, смотровые окна, диэлектрические детали.
1. ГЕТЕРОГЕННАЯ СИСТЕМА состоит из двух или неск. фаз, т.е. частей, отличающихся по св-вам и соприкасающихся по пов-стям раздела.
Молекулы, находящиеся в глубинном слое вещества полностью реализуют свои валентности
У молекул на пов-ти остаются нескомпенсированные валентности, за счёт чего пов-ный слой обладает избытком энергии- эта избыточная энергия называется свободной поверхностной энергией Гиббса. G=Ϭ*S, где Ϭ- удельная свободная поверхностная энергия применимая к единице площади.
Если в системе имеется жидкая фаза, то Ϭ называется- поверхностным натяжением- это работа затраченная на образование единицы пов-ти.
Так как все самопроизвольные процессы протекают в сторону свободной пов-ти энергии Гиббса.
G <0 она может быть уменьшена 2мя путями:
За счёт сокращения площади, при этом жидкость приобретает форму капли.
За счёт сорбции, при этом насыщаются не реализованные валентности в поверхностном слое.
2. Дисперсные системы, гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностъю раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме которой распределена дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов. твердых аморфных частиц, капель или пузырьков.
Классификация:
1) По фазовому составу: гомогенные и гетерогенные
2) По размеру частиц дисперстной фазы
· Грубодисперстные(размер > 100 км, видны вооруженным глазом, неустойчивы)
· Коллоидные растворы(от 1го до 100 км, видны под микроскопом, довольно устойчивы не расслаиваются)
· Истинные растворы(< 1го км, ионы, атомы, молекулы, являются гомогенными системами, способными очень долго не расслаиваться)
3) По агрегатному состоянию:
· аэродисперсные (газодисперсные) системы с газовой дисперсионной средой: аэрозоли (дымы, пыли. туманы), порошки. волокнистые материалы типа войлока.
· Системы с жидкой дисперсионной средой; дисперсная фаза может быть твердой (грубодисперсные суспензии и пасты, высокодисперсные золи и гели), жидкой (грубодисперсные эмульсии, высокодисперсные микроэмульсии и латексы) или газовой (грубодисперсные газовые эмульсии и пены).
· Системы с твердой дисперсионной средой: стеклообразные или кристаллические тела с включениями мелких твердых частиц, капель жидкости или пузырьков газа, например, рубиновые стекла, минералы типа опала, разнообразные микропористые материалы.
3. Сорбция - это процесс поглощения вещ-в из окружающей среды всем объёмом или поверхностью другого вещества.
Она делится на:
· Абсорбцию -поглощение вещ-ва из окружающей среды всем объёмом другого вещ-ва(газ в жидкости)
· Адсорбция - это сорбциальный процесс, приводящий к концетрированию вещ-ва на границе раздела фаз за счёт поглощения 1го пов-тью другого.
Абсорбция характерихуется
Г = Споверх.слой - Собъёма/S(m) [Г]=моль/м2кг
Вещество, которое поглощает другое вещ-во называется адсорбент, а поглощаемое адсорбат или адсортив.
Адсобция по механизму делится на:
· Физическую (осуществляется за счёт межмолекулярных сил Ван-Дер Ваальса М<0, экзотермический процесс, обратимый, обратный-десорбция).
· Химический (происходит за счёт химических взаимодействий: молекулы адсорбата с пов-ти адсорбента, процесс необратимый, реакция экзотермическая)
· Конденсация(конденсация влаги в порах строит. Металлов. За счёт чего происходит карозия, процесс обратимый, реакция экзотермическая.)
Так как процесс адсорбции зачастую обратим, устанавливается равновесие мжду процессом адсорбции и десорбции:
H>0
Адсорбция десорбция
H<0
На смещение равновсия влияют внешние факторы:
· Температура(с её повышением 1 и 3 вид адсорбции понижается, равновесие смещается в сторону десорбции)
· При повышении концентрации адсорбтива величина адсорбции сначала повышается, а потом достигает определённого значения и не меняется
4. СМАЧИВАНИЕ, поверхностное явление, наблюдаемое при контакте жидкости с твердым телом в присут. третьей фазы-газа (пара) или др. жидкости. Она может эту жидкость:
· Не смачивать (вода на парафине) 180° > q0 > 90°
· Частично смачивать (вода на не зачищенном металле) 90° > q0 > 0°
· Растекаться по ней (вода на зачищенном металле) q0=(примерно)0
Степень смачивания характеризуется углом смачивания. Угол смачивания (или краевой угол смачивания) это угол, образованный касательными плоскостями к межфазным поверхностям, ограничивающим смачивающую жидкость, а вершина угла лежит на линии раздела трёх фаз.
Предельное смачивание, завершающееся прилипанием 1й пов-ти в другой называют адгезия.
Когезия- это взаимодействие частиц внутри 1й фазы. Условием смачивания является превышение работы атгезии над работой когезии.
Измерение степени смачивания весьма важно во многих отраслях промышленности (лакокрасочная, фармацевтическая, косметическая и т. д.). К примеру, на лобовые стёкла автомобилей наносят особые покрытия, которые должны быть устойчивы против разных видов загрязнений. Состав и физические свойства покрытия стёкол и контактных линз можно сделать оптимальным по результатам измерения контактного угла[2].
К примеру, популярный метод увеличения добычи нефти при помощи закачки воды в пласт исходит из того, что вода заполняет поры и выдавливает нефть. В случае мелких пор и чистой воды это далеко не так, поэтому приходится добавлять специальные ПАВ. Оценку смачиваемости горных пород при добавлении различных по составу растворов можно измерить различными приборами.
5. Кальций широко распространен, в земной коре его содержится примерно 3% по массе. В природе встречается в связанном состоянии, важнейшие соединения - карбонат кальция CaCO3 (мел, известняк, мрамор), гипс CaSO4*2H2O, силикаты.
Кальций - это твердый металл белого цвета, проявляет степень окисления +2. Свободный кальций химически активен. При нагревании легко окисляется кислородом воздуха с образованием оксида:
2Ca + O2 = 2CaO
Кальций взаимодействует со всеми неметаллами. С галогенами реакция идет уже на холоде (с иодом только в присутствии влаги):
Ca+ Cl2 = CaCl2
При нагревании кальций реагирует с серой, фосфором, углеродом, азотом. Карбид кальция является ацетиленидом и при взаимодействии с водой разлагается с выделением ацетилена:
CaC2 + 2H2O = C2H2 + Ca (OH)2
Соединяется с водородом, образуя солеобразный гидрид CaH2. С холодной водой реагирует довольно медленно, быстрее при нагревании:
Ca + 2H2O = Ca (OH)2 + H2
Кальций бурно реагирует с разбавленными кислотами с образованием солей:
Ca + 2HCl = CaCl2 + H2
Получают кальций электролизом расплава хлорида кальция либо методом алюмотермии:
3CaO + 2Al = Al2O3 + 3Ca
Применение соединений кальция
Гидрид кальция
Нагреванием кальция в атмосфере водорода получают CaH2 (гидрид кальция), используемый в металлургии (металлотермии) и при получении водорода в полевых условиях.
Оптические и лазерные материалы
Фторид кальция (флюорит) применяется в виде монокристаллов в оптике (астрономические объективы, линзы, призмы) и как лазерный материал. Вольфрамат кальция (шеелит) в виде монокристаллов применяется в лазерной технике, а также как сцинтиллятор.
Карбид кальция
Карбид кальция CaC2 широко применяется для получения ацетилена и для восстановления металлов, а также при получении цианамида кальция (нагреванием карбида кальция в азоте при 1200 °C, реакция идет экзотермически, проводится в цианамидных печах).
Химические источники тока
Кальций, а также его сплавы с алюминием и магнием используются в резервных тепловых электрических батареях в качестве анода(например кальций-хроматный элемент). Хромат кальция используется в таких батареях в качестве катода. Особенность таких батарей — чрезвычайно долгий срок хранения (десятилетия) в пригодном состоянии, возможность эксплуатации в любых условиях (космос, высокие давления), большая удельная энергия по весу и объёму. Недостаток в недолгом сроке действия. Такие батареи используются там, где необходимо на короткий срок создать колоссальную электрическую мощность (баллистические ракеты, некоторые космические аппараты и.др.).
Огнеупорные материалы
Оксид кальция, как в свободном виде, так и в составе керамических смесей, применяется в производстве огнеупорных материалов.
Строительные материалы
Использование соединений кальция в производстве строительных материалов является самым масштабным из всех применений. Окись (и гидроокись) кальция используется и как связующее, и как пигмент в производстве строительных растворов, разного рода водорастворимых красок, побелок, при получении силикатного кирпича. Соединения кальция используются в производстве цемента, стекла. В качестве наполнителей - для приготовления замазок и шпатлёвок, красок и эмалей. Широко используется также алебастр (строительный гипс), для отливки лепных украшений, статуй и горельефов. как компонент в строительных растворах. Находит применение природный минерал мрамор - для отделки фасадов зданий, внутренних помещений, полов, для изготовления элементов интерьера, столешниц, подоконников и т.д.
Металлургия
Соединения кальция (в основном карбонат или гидрокарбонат) применяются для обмазок электродов в дуговой электросварке. Соединения кальция широко применяются для приготовления флюсов для плавки и сварки металлов.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 1471; Нарушение авторских прав?; Мы поможем в написании вашей работы!