
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Авогадро.Открыт в 1811 г. итальянским физиком А.Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул
|
|
|
|
При нормальных условиях (температура 0оС=273,15К и давление 1 атм =760 мм рт.ст.= 101325 Па=101,325кПа) один моль любого газа содержит 6,022045.1023 =6,02.1023 молекул (постоянная Авогадро) и занимает объем 22 414 см3=22,4 дм3 .
Закон Авогадро позволяет определить молярную массу газа если известна его плотность (ρ) при нормальных условиях
МВ=22,4 ρ (1.7)
или плотность при нормальных условиях, если известна молярная масса. Можно также определить молярную массу неизвестного газа (Мх), зная молярную массу известного газа (МВ) и отношение плотностей этих газов (ρх/ρВ)
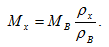 (1.8)
(1.8)
Отношение ρх/ρВ носит название относительной плотности одного газа по другому и обозначается буквой D. Например, если использовать относительную плотность неизвестного газа по водороду и воздуху, то формула (1.8) запишется следующим образом:
 (1.8а)(1.8б)
(1.8а)(1.8б)
Если условия, при которых находится газ, отличаются от нормальных, то для определения молярной массы газа можно использовать уравнение состояния идеальных газов Менделеева _ Клапейрона
 (1.9)
(1.9)
где р _ давление газа; V _ объем газа; mB _ масса газа; МВ _ молярная масса газа; Т – температура в градусах термодинамической шкалы Кельвина (К); R _ универсальная газовая постоянная, равная 8,314 Дж/(моль.К), или (л.кПа)/(моль.К) в СИ, или 0,08206 (л.атм)/(моль.К), если давление выражено в атмосферах, или 62,36 (л.мм рт. ст.)/(моль.К), если давление выражено в мм ртутного столба.
3) Итак, первый закон термодинамики утверждает:
Любое физическое тело имеет внутреннюю энергию U, которую можно увеличить двумя способами — подводя к телу теплоту Q или производя над ним работу А: D U = Q+A.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
ЭНТАЛЬПИЯОБРАЗОВАНИЯ (теплота образования), энтальпия р-ции образования данного в-ва (или р-ра) из заданных исходных в-в.Энтальпия образования хим. соединения наз. энтальпию р-ции образования данного соед. из простых в-в. В качестве простых в-в выбирают хим. элементы в их естественном фазовом и хим. состоянии при данной т-ре. Так, при 298 К для хлора простым в-вом служит газообразный хлор, состоящий из молекул С12, а для калия - металлич. К. Энтальпия образования твердого КС1 при 298 К - этоэнтальпия р-ции:
К(тв.) + 1/2С12= КС1(тв.).
Энтальпия образования КС1 (тв.) при 500 К соответствует р-ции: К(жидкий) + 1/2C12 = КС1(тв.), т. к. естественным фазовым состоянием (простым в-вом) для калия становится уже не кристалл, а жидкость (т-ра плавления К 336,66 К).
Энтальпия образования может быть определена при любой т-ре. Стандартные энтальпии образования 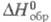 соответствуют р-циям образования, при к-рых и простые в-ва, и получающееся соед. находятся при давлении 1 атм (1,01 x 105 Па). По определению, для всех простых в-в при любой т-ре
соответствуют р-циям образования, при к-рых и простые в-ва, и получающееся соед. находятся при давлении 1 атм (1,01 x 105 Па). По определению, для всех простых в-в при любой т-ре  = 0 (см. Стандартное состояние). Для большинства хим. соед. энтальпии образования- отрицат. величины.
= 0 (см. Стандартное состояние). Для большинства хим. соед. энтальпии образования- отрицат. величины.
Единицы измерения энтальпии образования- Дж/г, Дж/моль.
В термодинамике р-ров (расплавов) под энтальпией образования понимают изменение энтальпии при изотермо-изобарном образовании 1 моля (1 г) р-ра (расплава) данного состава из чистых компонентов. Так, в двухкомпонентной системе KF-A1F3 энтальпияобразования расплава 50 %-ного молярного состава соответствует процессу: 1/2КF(жидкий) + 1/2А1F3(жидкий) = КF-А1F3(расплав, 50 мол. %).
Определение стандартных энтальпий образования смесей возможно при любой т-ре, как и энтальпий образования хим. соединений.Энтальпию образования смеси данного состава наз. часто энтальпией смешения. Неидеальные р-ры характеризуются избыточнойэнтальпией образования, к-рая представляет собой разницу между реальной энтальпией образования фазы данного состава иэнтальпией образования гипотетич. идеального р-ра того же состава (см. Растворы неэлектролитов).
Энтальпии образования определяют экспериментально калориметрич. измерениями. Второе и третье начала термодинамикипозволяют получать энтальпии образования из эксперим. данных. Теоретич. расчеты энтальпий образования хим. соед. пока неосуществимы. Возможны эмпирич. оценки энтальпии образования, напр., из энтальпий образования родственных соединений.
Энтальпии образования хим. соединений табулированы в термодинамич. справочниках и банках информации.
4) Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH < 0), относятся к экзотермическим, а с ее поглощением (Q < 0; ΔH > 0) - к эндотермическим. Химические уравнения, для которых указаны тепловые эффекты, называются термохимическими уравнениями. Например:
Н2(г) + 1/2О2(г) = Н2О(ж), 
где г – газ, ж – жидкость, r означает, что изменение энтальпии относится к химической реакции, (298) – температура системы; правый верхний индекс (о) указывает на стандартное состояние веществ, участвующих в реакции.
На теплоту образования веществ влияет их агрегатное и фазовое. Поэтому в термохимических уравнениях принято указывать это состояние (г - газ, ж - жидкость, т - твердое вещество, к - кристаллическая фаза).
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г.И. Гессом в 1840 г.
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
Закон Гесса. Открыт в 1840 г российским ученым Г.И.Гессом. Тепловой эффект реакции, протекающей при постоянном давленииили постоянном объеме не зависит от пути протекания реакции и определяется только природой и состоянием исходных веществ и конечных продуктов.
Рассмотрим процесс получения оксида углерода (IV) из графита:
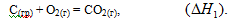
Эту же реакцию можно осуществить в две стадии через образование оксида углерода (II):
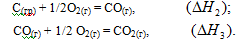
Эти реакции можно представить следующей схемой:

В соответствии с законом Гесса можно записать:
ΔН1 = ΔН2 + ΔН3 или ΔН1 - ΔН2 - ΔН3 = 0. (2.9)
Процессы, в которых система после ряда последовательных превращений возвращается в исходное состояние, называются круговыми процессами или термодинамическими циклами. Метод циклов используется для вычисления различных термодинамических свойств веществ.
Первое следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Энтальпия образования вещества В() это энтальпия реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Например. энтальпия образования нитрата натрия равна энтальпии реакцииNa(кр) + ½N2(г) + 3/2О2(г) = NaNO3(кр), 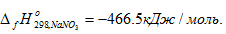 Энтальпия образования простых веществ при стандартных условиях принята равной нулю. Энтальпия является свойством вещества, также как и масса, объем и т.д. Энтальпия _ функция состояния системы, т.е. ее изменение не зависит от пути процесса, а определяется только состоянием системы в конце и начале процесса.
Энтальпия образования простых веществ при стандартных условиях принята равной нулю. Энтальпия является свойством вещества, также как и масса, объем и т.д. Энтальпия _ функция состояния системы, т.е. ее изменение не зависит от пути процесса, а определяется только состоянием системы в конце и начале процесса.
Энтальпия химической реакции в общем виде аА + bB = dD + eE (2.10)
определяется по уравнению 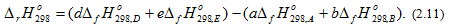
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия сгорания вещества В  это энтальпия реакции окисления кислородом 1 моль соединениядо образования высших оксидов. Например энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции: СН3ОН + 3/2О2 = СО2 + 2Н2О
это энтальпия реакции окисления кислородом 1 моль соединениядо образования высших оксидов. Например энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции: СН3ОН + 3/2О2 = СО2 + 2Н2О
Энтальпия химической реакции в общем виде (2.10) определяется по уравнению
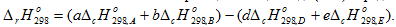
5) Состояние любой системы может быть охарактеризовано значениями непосредственно измеряемых параметров (р, Т и др.). Это характеристика макросостояния системы. Состояние системы может быть описано также характеристиками каждой частицы системы (атома, молекулы): координаты, частота колебания, частота вращения и т.д. Это характеристика микросостояния системы. Системы состоят из очень большого числа частиц, поэтому одному макросостоянию будет отвечать огромное число различных микросостояний. Это число называется термодинамической вероятностью состояния и обозначается (W).
Термодинамическая вероятность связана с другим свойством вещества – энтропией (S) – формулой Больцмана
 (2.13)
(2.13)
где R - универсальная газовая постоянная, а NA – постоянная Авогадро. Измеряется энтропия в Дж/(моль.К).
Физический смысл: энтропия является мерой неупорядоченности состояния системы. Энтропия системы увеличивается во всех процессах, когда возрастает неупорядоченность (нагревание, растворение, испарение, реакции разложения и т.п.) и уменьшается в процессах, идущих с увеличением упорядоченности (охлаждение, кристаллизация, сжатие и т.п.).Энтропия является функцией состояния, но в отличие от большинства других термодинамических функций возможно экспериментальное определение абсолютного значения энтропии вещества. Эта возможность основана на постулате М.Планка, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю» (третий закон термодинамики). На рис.2.1 видно, что при нуле Кельвина энтропия вещества равна нулю. При повышении температуры энтропия плавно увеличивается, а в точках фазовых переходов имеет место скачкообразное увеличение энтропии, определяемое соотношением
 (2.14)
(2.14)
где Δ ф..п.S, Δф.п.Н и Тф.п. изменение энтропии, энтальпии и температура фазового перехода, соответственно.Энтропию вещества B в стандартном состоянии обозначают  . Для многих веществ абсолютные значения стандартных энтропий определены и приводятся в справочных изданиях.Энтропия, также как внутренняя энергия и энтальпия, является функцией состояния, поэтому изменение энтропии системы в процессе не зависит от его пути и определяется только начальным и конечным состоянием системы. Изменение энтропии в ходе химической реакции (2.10) может быть найдено, как разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ
. Для многих веществ абсолютные значения стандартных энтропий определены и приводятся в справочных изданиях.Энтропия, также как внутренняя энергия и энтальпия, является функцией состояния, поэтому изменение энтропии системы в процессе не зависит от его пути и определяется только начальным и конечным состоянием системы. Изменение энтропии в ходе химической реакции (2.10) может быть найдено, как разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ
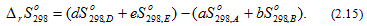
Понятие энтропии используется в одной из формулировок второго закона термодинамики: в изолированных системах могут самопроизвольно протекать толькопроцессы, идущие с увеличением энтропии (ΔS>0). Под изолированными системами понимаются системы, не обменивающиеся с окружающей средой ни веществом, ни энергией. Системы, в которых протекают химические процессы, к изолированным системам не относятся, т.к. они обмениваются с окружающей средой энергией (тепловой эффект реакции).
6) Энергия Гиббса (изобарно-изотермический потенциал). Во многих случаях самопроизвольные процессы (процессы, происходящие без подвода энергии от внешнего источника) в природе протекают при наличии разности потенциалов, например, разность электрических потенциалов, обусловливает перенос заряда, а разность гравитационных потенциалов – падение тела. Эти процессы заканчиваются при достижении минимума потенциала. Движущей силой химических процессов, протекающих при постоянных давлении и температуре является изобарно-изотермический потенциал, называемый в настоящее время энергией Гиббса и обозначаемый G. Изменение энергии Гиббса в химическом процессе определяется соотношением
ΔG = ΔH –TΔS, (2.16)
где ΔG – изменение энергии Гиббса химического процесса; ΔH – изменение энтальпии химического процесса; ΔS – изменение энтропии химического процесса; Т – температура в Кельвинах.
Уравнение (2.16) может быть представлено в следующем виде: ΔH = ΔG + TΔS. (2.17)
Смысл уравнения (2.17) в том, что часть теплового эффекта реакции расходуется на совершение работы (ΔG), а часть рассеивается в окружающую среду (TΔS).
Энергия Гиббса является критерием принципиальной возможности самопроизвольного протекания реакции. Если в ходе реакции энергия Гиббса уменьшается, то процесс может протекать в данных условиях самопроизвольно ΔG < 0. Процесс в данных условиях неосуществим, если ΔG > 0. Реакция является обратимой, т.е. может протекать и в прямом и в обратном направлении, если ΔG = 0 (термодинамическое условие химического равновесия).
Эти соотношения применимы также к фазовым равновесиям, т.е. случаям, когда в равновесии находятся две фазы (агрегатных состояния) одного и того же вещества, например, лед и жидкая вода.
Энтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔS и ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов.
Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|.
Если, энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составляющей, при условии, что |ΔH|>|TΔS|.
Влияние температуры на направление реакции. Изменение знака энергии Гиббса произойдет при
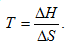 (2.21)
(2.21)
Очевидно, что смена знака энергии Гиббса с изменением температуры возможна только в двух случаях: 1) ΔН>0 и ΔS>0 и 2) ΔН<0 и ΔS<0.
Стандартная энергия Гиббса образования -  это изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Энергия Гиббса образования простых веществ принимается равной нулю. Стандартные энергии Гиббса образования веществ можно найти в соответствующих справочниках.
это изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Энергия Гиббса образования простых веществ принимается равной нулю. Стандартные энергии Гиббса образования веществ можно найти в соответствующих справочниках.
Энергия Гиббса химической реакции. Энергия Гиббса является функцией состояния, т.е. ее изменение в процессе не зависит от пути его протекания, а определяется исходным и конечным состоянием системы. Следовательно, энергию Гиббса химической реакции (2.10) можно рассчитать по формуле

Если условия отличаются от стандартных, то для нахождения ΔrG может быть использовано уравнение изотермы Вант-Гоффа, которое для реакции (2.11) между газами записывается как
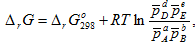
а между растворенными веществами -
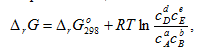 (2.24)
(2.24)
где 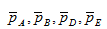 _ относительные парциальные давления соответствующих веществ; сА, сВ, сD, cE _концентрации соответствующих растворенных веществ, а, b, c, d – соответствующие стехиометрические коэффициенты.
_ относительные парциальные давления соответствующих веществ; сА, сВ, сD, cE _концентрации соответствующих растворенных веществ, а, b, c, d – соответствующие стехиометрические коэффициенты.
Если реагирующие вещества находятся в стандартном состоянии, то уравнения (2.23) и (2.24) превращаются в
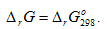
7)Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость
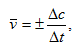 (3.1.)
(3.1.)
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак (-) – что вещество расходуется в ходе реакции.
Истинная (мгновенная) скорость реакции определяется соотношением
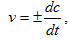 (3.2)
(3.2)
где dc – бесконечно малое изменение концентрации вещества за бесконечно малый промежуток времени dt.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от концентрации. Все химические реакции можно разделить на гомогенные и гетерогенные. К гомогенным реакциям относятся реакции, протекающие между веществами, находящимися в одном агрегатном состоянии, если между ними отсутствуют поверхности раздела. К гомогенным реакциям относятся реакции между газами, неограниченно смешивающимися жидкостями и жидкими растворами. Гомогенные реакции протекают в объеме, т.е. имеются наиболее благоприятные условия для контакта молекул реагирующих веществ.
Реакции между веществами, находящимися в разных агрегатных состояниях, или в одном агрегатном состоянии, но разделенных поверхностями раздела относятся к гетерогенным реакциям. К ним относятся, например, реакции между газом и жидкостью, двумя несмешивающимися жидкостями, механическими смесями твердых веществ. В гетерогенных реакциях химический процесс протекает только на поверхностях раздела реагирующих фаз.
Зависимость скорости гомогенной реакции от концентрации определяется законом действующих масс (закон Гульдберга и Вааге, 1864-1867 ): Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
Для обратимой химической реакции, записанной в общем виде,
 (3.3)
(3.3)
скорость прямой реакции равна 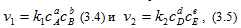
где сA, cB, cD, cE – концентрации реагирующих веществ, моль/л; a, b,d,e -стехиометрические коэффициенты или порядок реакции по реагентуA,B,DилиE; k1иk2 константы скоростей химических реакций.
Константа скорости химической реакцииk зависит от температуры и природы реагирующих веществ, но не зависит от их концентрации. Если концентрации реагирующих веществ равны единице, то константа скорости численно равна скорости химической реакции.
Уравнения (3.4) и (3.5) называются кинетическими уравнениями химических реакций.
Скорость гетерогенных реакций не зависит от объемной концентрации реагирующих веществ, т.к. реакция протекает только на поверхности раздела фаз. Чем выше степень измельчения веществ, тем больше их поверхность и тем выше скорость протекания реакций. Скорость гетерогенных реакций зависит также от скорости подвода реагирующих веществ к поверхности раздела фаз и от скорости отвода продуктов реакции. Поэтому перемешивание реакционной смеси ускоряет протекание гетерогенной реакции.
Концентрация газообразных веществ может быть выражена через парциальные давления. Парциальное давление газа в смеси равно тому давлению, которое производил бы газ, если бы он занимал объем всей смеси при тех же условиях. Парциальное давление i-го компонента газовой смеси  может быть рассчитано по формуле
может быть рассчитано по формуле
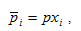 (3.6)
(3.6)
где р - общее давление смеси; xi – объемная или молярная доля i-го компонента в смеси.
Общее давление смеси газов равно сумме парциальных давлений компонентов:
 (3.7)
(3.7)
Для прямой реакции (3.3), если вещества А и В находятся в газообразном состоянии, то выражение для скорости реакции запишется следующим образом:
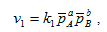 (3.8)
(3.8)
где 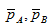 - парциальные давления веществ А и В.
- парциальные давления веществ А и В.
При изменении общего давления в n раз во столько же раз изменяется и парциальное давление каждого компонента, и, соответственно изменяется скорость реакции.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 587; Нарушение авторских прав?; Мы поможем в написании вашей работы!