
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени
|
|
|
|
Различают среднюю скорость 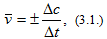
где Δс=с2-с1 – изменение концентрации вещества за промежуток времени Δt=t2-t1. Знак (+) означает, что вещество образуется, а знак (-) – что вещество расходуется в ходе реакции.
Основными факторами, определяющими скорость реакции, являются концентрация, температура и катализатор. Скорость реакций с участием газообразных реагентов зависит также от давления.
Зависимость скорости реакции от температуры. Для большинства реакций справедливо правило Вант-Гоффа: Повышение температуры на 10К увеличивает скорость большинства реакций в 2-4 раза:
 (3.9)
(3.9)
где  - скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции
- скорости реакции при Т1 и Т2; γ – термический коэффициент скорости химической реакции 
Молекулы газов и жидкостей испытывают ежесекундно огромное число столкновений. Только очень малая доля столкновений заканчивается химическими превращениями. Такие столкновения называются эффективными соударениями. Молекулы - активными молекулами с большей энергией. Избыточная энергия необходима молекулам для преодоления сил отталкивания внешних электронных оболочек и для образования активированного комплекса, т.е. промежуточного соединения между исходными веществами и конечными продуктами. В активированном комплексе старые связи еще не полностью разрушены, а новые еще не полностью образовались.

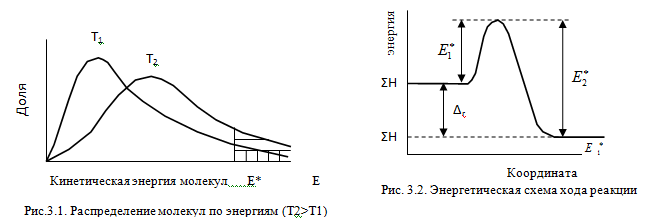
Изменение энергии в ходе химической реакции показано схемой процесса активации (рис.3.2). По оси ординат отложена потенциальная энергия системы. Абсцисса - координата реакции или реакционного пути. В процессе химического превращения переход системы из начального состояния с энергией ΣНi в конечное состояние с ΣНf происходит через энергетический барьер  .
.
Энергия активации (Е*) - это энергия, необходимая для перевода в состояние активированного комплекса 1 моль реагирующих веществ. Разность ΣНf - ΣНi составляет тепловой эффект реакции (ΔrH). Для обратной реакции тепловой эффект будет иметь ту же величину, но противоположный знак. Для обратной реакции энергия активации составит величину. 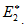
Зависимость константы скорости химической реакции от температуры описывается уравнением Аррениуса: 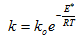 (3.10)
(3.10)
где k – константа скорости реакции; ko – константа, зависящая от природы реагирующих веществ; Е* - энергия активации; R – универсальная газовая постоянная; Т – температура, К. Константа скорости, а следовательно и скорость химической реакции экспоненциально растет с увеличением температуры.
9) Многие химические реакции протекают в одном направлении до полного исчерпания реагирующих веществ. Такие реакции называются химически необратимыми. Другие реакции протекают вначале в прямом направлении, а затем в прямом и обратном благодаря взаимодействию продуктов реакции. В результате образуется смесь, содержащая одновременно исходные вещества и продукты реакции. Такие реакции называют химически обратимыми. В результате химически обратимого процесса наступает истинное (устойчивое) химическое равновесие, признаками которого являются:
1) в отсутствии внешних воздействий состояние системы остается неизменным неограниченно долго;
2) любое изменение внешних условий приводит к изменению состояния системы;
3) состояние равновесия не зависит от того, с какой стороны оно достигнуто.
Кроме истинных равновесий очень часто встречаются кажущиеся (ложные, заторможенные) равновесия, когда состояние системы сохраняется во времени очень долго, но небольшое воздействие на систему может привести к сильному изменению ее состояния.
Рассмотрим обратимую химическую реакцию между йодом и водородом 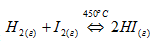
Скорости прямой и обратной реакций определяются соотношениями
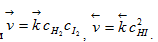
Начиная с некоторого момента состав реакционной смеси перестает изменяться, что отвечает равенству скоростей прямой и обратной реакции 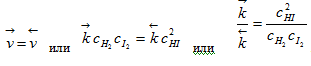
Это состояние реагирующей системы называется химическим равновесием. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, следовательно, химическое равновесие является динамическим равновесием.
Отношение констант скоростей прямой и обратной реакций является также величиной постоянной и носит название константы химического равновесия. Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия.
Для обратимой реакции, записанной в общем виде аА + bB ↔ dD + eE константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом:

через парциальные давления константа равновесия реакции будет выглядеть так:

Константа равновесия гетерогенных реакций не включает концентрации твердых веществ.
Смещение химического равновесия. Принцип Ле Шателье. Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия. Направление смещения равновесия определяется принципом Ле Шателье: Любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения.
1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса.
2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа моль газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смешается в сторону увеличения числа моль газообразных веществ, т.е. в сторону увеличения давления.
3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию и наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения.
10) До середины ХIХ века атом считался мельчайшей и неделимой частицей материи. Открытие электрона и радиоактивности доказали сложность строения атома. Электрон был открыт в 1897 г. английским ученым Дж. Дж. Томсоном; название было дано в 1891 г. англичанином Дж. Стони. Заряд и масса были определены в 1909 г. Р. Малликеном. Заряд электрона принят в настоящее время за единицу отрицательного электричества.
В 1926 г. Э.Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому, физический смысл имеет только |ψ|2, который характеризует вероятность нахождения электрона в данном объеме пространства. Термином орбиталь обозначают также область пространства, в которой наиболее вероятно нахождение электрона. Решение уравнения Шредингера определяется набором четырех чисел, получивших название квантовых чисел.
Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N, O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождается излучением или поглощением квантов энергии.
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем.
Орбитальное (побочное, азимутальное) квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем (подоболочкой). Граничная поверхность s-орбиталей имеет форму сферы (рис.4.1,а), р-орбиталей – гантели (рис.4.1,b-d). Граничные поверхности d-орбиталей показаны на рис.4.1,e-i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s, p, d, f (Es<Ep<Ed<Ef).
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. d-подуровень содержит пять орбиталей, s-подуровень – одну (рис.4.1,a), p-подуровень – три (рис.4.1,b-d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 676; Нарушение авторских прав?; Мы поможем в написании вашей работы!