
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Критерий направления реакции в стандартных условиях
|
|
|
|
Закон Вант-Гоффа: осмотическое давление равно тому давлению,которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.
Из закона Вант-Гоффа следует, что растворы различных неэлектролитов одинаковой концентрации, находящиеся при одинаковой температуре являются изотоническими, т.е. имеющими одинаковое осмотическое давление.
19) Отношение числа диссоциированных молекул к общему числу растворенных молекул называетсястепенью диссоциации (α). Степень диссоциации выражают в долях единицы или в процентах. В зависимости от степени диссоциации веществ в 0,1 н растворе при 298К электролиты иногда условно подразделяют на сильныеα>0,3; средние 0,3<α > 0.03 и слабые α<0,03. Степень диссоциации зависит от химической природы вещества, температуры, концентрации и увеличивается с понижением концентрации и увеличением температуры раствора. Большинство солей, многие кислоты (HCl, HNO3, H2SO4), гидроксиды щелочных и щелочноземельных металлов (NaOH, KOH, Ca(OH)2) относятся к сильным электролитам. Примерами электролитов средней силы являютсяH3PO4, H2SO3, H2C2O4. К слабым электролитам относятся большинство органических кислот и оснований, H2СO3,H2SiO3, H2S, HCN, Mg(CN)2 и др.
Определение степени диссоциации из измерений электропроводности и по изотоническому коэффициенту.
1) Эквивалентная электропроводность прямо пропорциональна числу ионов в растворе и, следовательно, степени диссоциации α
λ=Кα, (7.20)
где К – коэффициент пропорциональности.
Степень диссоциации, также как и эквивалентная электропроводность, увеличивается при понижении концентрации. В очень разбавленном (бесконечно разбавленном) растворе электролит диссоциирует полностью, т.е. α=1, следовательно
λ ∞ =К, (7.21)
где λ ∞ - эквивалентная электропроводность бесконечно разбавленного раствора. Эту величину получают экстраполируя (продолжая) концентрационную зависимость λ=f(c) на нулевую концентрацию электролита (бесконечно разбавленный раствор).
Подставляя значение К из ф-лы (7.21) в (7.20) получим:
α =λ/λ∞ (7.22)
Следовательно, степень диссоциации равна отношению эквивалентной электропроводности при данной концентрации к эквивалентной электропроводности при бесконечном разбавлении.
2) Пусть раствор содержит N моль электролита, степень диссоциации которого равна α. Тогда число моль продиссоциированного электролита составит αN, а недиссоциированного – N(1-α). Если молекула диссоциирует на nионов, то число моль ионов в растворе составит nαN и общее число частиц растворенного вещества в растворе N(1-α) + nαN. Изотонический коэффициент показывает, во сколько раз увеличивается число частиц растворенного вещества в результате диссоциации, т.е.

откуда получим для степени диссоциации
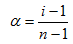 (7.23)
(7.23)
Из (7.23) следует, что при полной диссоциации электролита (α=1) изотонический коэффициент равен числу ионов, на которое распадается электролит (i=n).
20) Процесс диссоциации слабых электролитов является обратимым и характеризуется константой диссоциации. Для электролита КnАm выражения для процесса диссоциации и константы диссоциации запишутся следующим образом:
 (7.27)
(7.27)
В выражении (7.27) концентрации ионов при значительных ионных силах (~ >0,001) следует заменить на активности.
Константа диссоциации простым образом связана со степенью диссоциации. Например, константа диссоциации уксусной кислоты
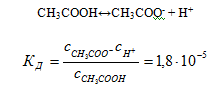
Пусть α – степень диссоциации кислоты, а с – ее концентрация. Тогда концентрация каждого из ионов будет равна αс, а концентрация недиссоциированных молекул будет (1-α)с. Подставляя эти величины в Кд получим:  (7.28)
(7.28)
Это уравнение носит название закон разбавления Оствальда и справедливо для слабых электролитов, образованных ионами с одинаковыми зарядами. Для слабых электролитов α<0,03, следовательно, можно принять 1-α≈1. Тогда ур-ние (7.28) примет вид

21) Степень диссоциации таких электролитов близка к 1.
К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
П рименительно к сильным электролитам используют понятие «кажущаяся степень диссоциации». Кажущаяся степень диссоциации, также как и степень диссоциации в концентрированных растворах меньше единицы и увеличивается с уменьшением концентрации, стремясь к единице. Но в растворах сильных электролитов это связано с образованием из сольватированных ионов ассоциатов, которые ведут себя как недиссоциированные молекулы, т.е. не участвуют в переносе электричества и движутся как единое целое. Основное отличие ионных ассоциатов от недиссоциированных молекул в том, что в ассоциатах расстояние между сольватированными ионами значительно больше, чем в молекулах, т.к. между ионами находится растворитель. При уменьшении концентрации доля ассоциатов уменьшается, число частиц растворенного вещества увеличивается, и кажущаяся степень диссоциации растет.
Активность. Ионная сила. Активность, будучи подставлена в выражения законов для разбавленных растворов неэлектролитов, делает эти формулы применимыми для растворов электролитов. Аналитическая концентрация связана с активностью простым соотношением:
а = γс, (7.24)
где а – активность; с – аналитическая концентрация; γ – коэффициент активности.
Коэффициенты активности показывают меру отличия свойств реальных растворов от идеальных.
Активности определяют экспериментально, измеряя различные свойства растворов (давление насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания, осмотическое давление и многие другие).
Коэффициенты активности могут быть определены исходя из активности по формуле (7.24). Коэффициенты активности отдельных ионов не могут быть определены экспериментально, но могут быть рассчитаны для разбавленных водных растворов электролитов с помощью уравнения Дебая-Хюккеля:
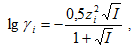 (7.25)
(7.25)
где γi – коэффициент активности иона; zi –заряд иона; I – ионная сила раствора, определяемая соотношением:
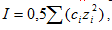 (7.26)
(7.26)
где сi – концентрация и zi –заряд ионов, находящихся в растворе.
Из (7.25; 7.26) следует, что ионная сила раствора, а следовательно и коэффициент активности иона определяются всеми ионами, присутствующими в данном растворе.
Отметим, что уравнение (7.25) справедливо при 0,001<I<0,2. При ионных силах, меньших 0,001 коэффициенты активности мало отличаются от единицы, а при I>0,2 уравнение (7.25) становится слишком грубым приближением.
22) Ионное произведениеводы. Вода является слабым электролитом и диссоциирует по схеме:
2Н2О ↔ Н3О+ + ОН-
Ионы Н+ в воде и водных растворах практически отсутствуют, т.к. равновесие реакции
Н2О + Н+ ↔ Н3О+
полностью смещено влево, обычно реакцию диссоциации воды записывают упрощенно
Н2О ↔ Н+ + ОН-
Константу диссоциации воды можно записать:

В чистой воде концентрации ионов водорода и гидроксида очень малы и вместо активностей можно использовать аналитические концентрации. Диссоциация практически не влияет на концентрацию воды, поэтому
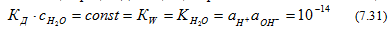
Эта величина носит название ионное произведение воды. При 295 К (22оС) ионное произведение равно точно 10-14.
Диссоциация воды протекает с поглощением тепла, поэтому при повышении температуры КW возрастает Из ур-ния (7.31) следует, что в чистой воде концентрации ионов водорода и гидроксила равны и составляют при 295 К

Такой раствор называют нейтральным. Если 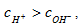 то раствор будет кислым, а если
то раствор будет кислым, а если  то раствор щелочной.
то раствор щелочной.
Для характеристики кислотности среды обычно используют вместо концентрации водородный показатель (рН) – отрицательный десятичный логарифм активности (концентрации) ионов водород:
 (7.32)
(7.32)
При 295 К в нейтральной среде рН=7, в кислой – рН<7, в щелочной - pH>7.
Несколько реже используют гидроксидный покадатель (рОН) отрицательный десятичный логарифм активности (концентрации) ионов гидроксила:
 (7.32а)
(7.32а)
При 295 К в нейтральной среде рОН=7, в кислой – pОH>7, в щелочной - рОН<7.
рН+рОН=14.
Величина рН может контролироваться с помощью приборов (рН-метров) или посредством специальных реактивов, называемых индикаторами. Окраска индикаторов изменяется в зависимости от концентрации ионов водорода. Кислотно-основные индикаторы представляют собой слабые органические кислоты (HInd) или основания (IndOH), диссоциирующие по схемам:
HInd↔H+ + Ind-
IndOH↔Ind+ + OH-
Молекулярная и ионная формы индикаторов имеют разные окраски. При избытке ионов водорода HIndнаходится преимущественно в молекулярной форме, а IndOH – в ионной, а при избытке ионов гидроксила, наоборот -HInd находится преимущественно в ионной форме, а IndOH –в молекулярной.
Изменение окраски индикатора происходит в некотором интервале рН, называемом интервал перехода индикатора, определяемом величиной рКHind.
23) Равновесие осадка трудно растворимого, сильного электролита KtnAnm с его ионами в растворе описывается уравнением

Константа равновесия этого процесса носит название произведения растворимости и определяется только произведением концентраций ионов электролита в растворе и не зависит от концентрации твердого компонента:
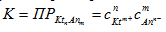
Произведение растворимости есть произведение концентраций ионов сильного, плохо растворимого электролита в степенях их стехиометрических коэффициентов в его насыщенном растворе. В случаях, когда ионная сила раствора достаточно велика (I>0,001) вместо концентраций ионов следует использовать активности. Величина произведения растворимости постоянна при постоянной температуре. Произведение растворимости может быть использовано для характеристики насыщенности раствора:
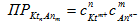 - раствор насыщенный;
- раствор насыщенный;
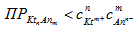 - концентрация выше концентрации насыщенного раствора, выпадает осадок;
- концентрация выше концентрации насыщенного раствора, выпадает осадок;
 -раствор ненасыщенный, осадок растворяется.
-раствор ненасыщенный, осадок растворяется.
Равновесие между ионами и молекулами в растворах слабых электролитов подчиняется принципу Ле Шателье. В соответствии с принципом Ле Шателье, при разбавлении раствора слабого электролита равновесие смещается в сторону диссоциации, т.к. это ведет к увеличению числа частиц растворенного вещества, уменьшившегося в результате разбавления. Введение одноименного иона снижает степень диссоциации электролита. Растворимость труднорастворимого электролита от введения в раствор одноименных ионов уменьшается.
24)Процессы, сопровождающиеся изменением степеней окисления реагирующих частиц, называют окислительно-восстановительными реакциями. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно.
Эти реакции могут быть использованы для получения электрического тока. Равным образом процессы окисления и восстановления могут протекать под действием электрического тока. В этих двух случаях окислительно-восстановительные реакции относят к электрохимическим процессам.
В окислительно-восстановительной реакции
Zn + CuSO4 = ZnSO4 + Cu
атом цинка отдает два электрона
Zn -2e → Zn2+,
а ион меди принимает два электрона
Cu2+ + 2e → Cu
Процесс потери электронов называют окислением, а вещество, отдающее электроны является восстановителем; цинк является восстановителем, он окисляется. Процесс принятия электронов называют восстановлением, а вещество, принимающее электроны является окислителем; ион меди Cu2+ является окислителем, он восстанавливается. Процессы окисления и восстановления протекают одновременно; окисление одного вещества всегда связано с восстановлением другого.
Если в реакционной смеси присутствуют как исходные вещества, так и образуемые ими при протекании ОВР продукты реакции или, иначе говоря, два окислителя и два восстановителя, то направление реакции определяется тем, какой из окислителей в данных условиях в соответствии с уравнением Нернста окажется более сильным.
Любая запись уравнения ОВР предполагает определенный выбор окислителя в левой части уравнения. Если в стандартных условиях этот окислитель сильнее, реакция пойдет в прямом направлении, если нет – в обратном.
Стандартный потенциал окислительно-восстановительной пары, в которой окисленной формой является выбранный нами окислитель, назовем потенциалом окислителя φоОк, а стандартный потенциал другой пары, в которой восстановленной формой является выбранным нами восстановитель – потенциалом восстановителя φоВс.
Величину Δφо = φоОк – φоВс назовем стандартной разностью окислительно-восстановительных потенциалов.
Если Δφо > 0, реакция в стандартных условиях протекает в прямом направлении; если Δφо < 0, то в обратном.
Действительный смысл этого критерия: если Δφо> 0, то окислитель в левой части ионного уравнения ОВР сильнее второго окислителя в правой части уравнения.
Эквивалентом окислителя (восстановителя) называется такое его наименьшее количество, которое соответствует одному присоединенному (отданному) им электрону в конкретном окислительно-восстановительном процессе.
Математически это утверждение будет соответствовать формуле:
Эоx= νох/nē.
Аналогично и для восстановителя:
Эred = νred/nē
При этом количество вещества эквивалента окислителя (νэох) и восстановителя (νэred) рассчитываются иначе, чем в случае химических эквивалентов.
К окислительно-восстановительным системам также применим закон эквивалентов, согласно которому:
СN(ox).V(ox) = CN(red).V(red).
Для количественной характеристики окислительно - восстановительных процессов используют, в частности, молярную массу эквивалентов окислителя и восстановителя определяемую по формуле - она равна частному от деления молярной массы окислителя или восстановителя на число электронов, принятых или отданных одной структурной единицей вещества:
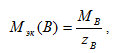 (8.1)
(8.1)
где zB – число эквивалентности, равное числу электронов, принятых или отданных одной структурной единицей вещества.
Уравнения окислительно-восстановительных процессов составляются с помощью метода электронного баланса.
Процесс передачи электронов от окислителя к восстановителю является самопроизвольным и обратимым, при этом система в целом остается электрически нейтральной.
В окислительно-восстановительной системе, содержащей одновременно и окисленную и восстановленную фазы,отсутствует градиент потенциала (разность зарядов), в ней всегда соблюдается электронный баланс.
25) В химических источниках тока происходит прямое преобразование химической энергии в электрическую. Основными достоинствами химических источников тока являются автономность и высокий КПД, а основным недостатком – очень высокая стоимость получаемой электроэнергии.
Химические источники тока подразделяют на гальванические элементы, аккумуляторы и топливные элементы.
Гальванические элементы – химический источник тока, в котором реагенты расходуются в ходе его работы. После исчерпания реагентов гальванический элемент не может быть более использован. В основе действия гальванического элемента может быть химический процесс или процесс выравнивания концентраций двух электролитов – растворов одного и того же вещества. По этому критерию гальванические элементы делятся на химические и концентрационные.
Аккумуляторы отличаются от гальванических элементов тем, что после исчерпания реагентов работоспособность аккумулятора может быть восстановлена пропусканием тока в направлении, обратном направлению тока при работе. Процесс выработки электрической энергии носит название разряд, а процесс восстановления работоспособности аккумулятора – заряд. При разряде химическая энергия превращается в электрическую, а при заряде – электрическая в химическую. Аккумулятор это гальванический элемент многоразового использования.
Топливные элементы – это гальванические элементы, требующие в процессе работы расхода окислителя и восстановителя, подаваемых извне. В качестве восстановителя может быть использован водород, природный газ, метанол и др., в качестве окислителя обычно применяют кислород воздуха. Наиболее разработана конструкция топливного элемента, работающего на водороде и кислороде.
В электрохимии процессы окисления носят название анодных процессов, а электрод, на котором протекает окисление называется анод; соответственно, процессы восстановления называются катодными процессами, а электрод, на котором проходит восстановление носит название катод.
Электродным потенциалом называется величина, равная ЭДС гальванического элемента, составленного из данного электрода и стандартного водородного электрода.
ЭДС электрохимического элемента равна разности электродных потенциалов:
Е = φ1 - φ2
Электродный потенциал электрода считается положительным, если в гальваническом элементе со стандартным водородным электродом данный электрод является катодом, и отрицательным - если анодом.
ЭДС «работающего» гальванического элемента должна быть положительна; иначе электродные процессы идут в обратном направлении (происходит переполюсовка электродов).
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 366; Нарушение авторских прав?; Мы поможем в написании вашей работы!