
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соли, основные свойства. Гидролиз солей. Примеры
Периодически и непериодически изменяющиеся свойтсва элементов по их расположению в таблице Менделеева. Энергия ионизации атомов, сродство к электрону. Понятие об элеткроотрицательности.
БИЛЕТ7
Периодический закон Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Новая формульровка: Сво-ва хим. элементов, а также формы и сво-ва соединений элементов наход. в период. зависимости от величины заряда ядра их атомов.
Разделив все элементы на периоды и располагая один по другим так, чтобы сходные по свойствам и типу образуемых соед-ий элементы находились друг над другом, Менделеев составил таблицу, названную им период. системой элементов по группам и рядам. Соврем-я таблица состоит из 10 гориз. рядов и 8 вертик. столбцов или групп, в к-ых один под другим расположены сходные между собой элементы.
Период (7) -гориз. ряд элементов, располож. в порядке возраст. порядкового номера. В пределах периода с возрастанием поряд. номера изменяются свой-ва элементов:
* Метал. сво-ва ослабевают; *Неметал. сво-ва усиливаются; * Возрастает валентность по кислороду (от 1 до 8); *Уменьшение валентности по водороду (от 4 до 1, начиная с 4 группы);* Сво-ва соед-ий изменяются от основных через амфотерные к кислотным.
В пределах мал. периодов изменение свойств идет быстрее, чем в больших. У элем-ов больших периодов сначала происходит заполнение не внешнего, а предвнеш. электр-го слоя, поэтому большие периоды делятся на 2 ряда. Элементы четных рядов больших периодов являются металлами, т.к. содержит 1,2 ē на внешнем уровне.
С изменением числа ē на внеш. уровне у элементов одного и того же периода слева на право незначительно, уменьшается R. При увел. числа ē увелич. сила Кулоновского взаимодействия.
Группа (8). В каждой группе выделяется главная и побочная подгруппа.
* Главная подгр. (А) образована элементами больших и мал. периодов, имеющих одинаковое число ē на внешнем уровне, равное № группы. Поэтому сво-ва элементов сходны и они образуют семейства.
*Побочные подгруппы(В) образованы только элементами больших периодов. Они содержат не внешнем уровне 1-2 ē и являются Металлами. Степень окисления может быть не равна № группы. Такая особенность послужила основой деления групп на подгруппы.
Только элементы А подгр.(начин. с 4) образуют летучие соед-я. В пределах А подгруппы металл-ие свойства ↑, а неметалл. ослабевают, т.к ↑ R атома и лёгкость отдачи ē. Самый активный Ме – Fr(франций),самый активный неМе – F(фтор).
Энергия ионизации – энергия, необх-ая для такого возбуждения ē, чтобы он смог отделиться от атома. Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.Для многоэлектронного атома существуют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.Энергия ионизации всегда имеет эндоэнергетическое значение (это понятно, так как чтобы оторвать электрон от атома, требуется приложить энергию, самопроизвольно это произойти не может).На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации, электрона;мера проникающей способности этого электрона;межэлектронное отталкивание среди наружных (валентных) электронов.На энергию ионизации оказывают влияние также и менее значительные факторы, такие, как квантовомеханическое обменное взаимодействие, спиновая и зарядовая корреляция и др.
Энергии ионизации элементов измеряется в Электронвольт на 1 атом или в Джоуль на моль. Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).Э + e− = Э− + εСродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями
Электроотрицательность – характеризует способность атома присоединять ē, при образовании хим. связи. ЭО элемента не является постоянной величиной: она зависит от валентности, проявляемой атомом в соответствующем соединении. ЭО зависит от заряда иона. Чем более типичным Ме является элем-т, тем ниже его ЭО; чем более типичным является элем-т, тем выше его ЭО.
2. Водородная связь. Вандерваальсово взаимодействие. Размеры атомов и ионов. Водородная связь – сила притяжения, возникающая между атомами Н и электроотрицательными атомами. Условием образования водородной связи является высокая ЭО атома, непосредственно связанного в молекуле с атомом водорода. Только при этом условии электронное облако атома Н достаточно сильно смещается в сторону атома-партнера, а последний приобретает высокий эффективный отрицательный заряд. Именно поэтому водородная связь характерна для соед-ий самых ЭО элементов: F,O,N, реже Cl,Br,S. *Межмолекулярные – вода, аммиак. фтороводород, кислоты, спирты;* внутримолекулярные - белки, нуклеиновые кис-ты. Сво-ва вещ-в: 1. растворимость в-в в воде:2. жидкое агрегатное состояние;3. повышение темпер-ры плавления и кипения. Ван-дер-ваальсовые силы – взаимодействие, проявляющееся во всех молекулах без исключения. Очень слабые силы (их энергия не превышает 8 кДж/моль), они являются первой причиной перехода большинства вещ-в из газообр-го состояния в жидкое, устойчивости молекулярных кристаллов, адсорбции газов поверхн-ми тверд. тел.К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий: Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями. Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. Атомный радиус – равен половине расстояния м/у ядрами 2-х одинаковых атомов. Различают атомный радиус Ме, ковалентный (неМе), R атомов благородных газов, а так же Ван-дер-ваальсовый радиус. Эти радиусы зависят от вида связи. Атомный радиус подчиняется простому закону сложения (аддитивности) Ионный радиус – это одна из 2-х частей межъядерного расстояния м\у соседними одноатомными простыми ионами. Ионный радиус зависит от многих факторов, таких как заряд и размер ядра, количество электронов в электронной оболочке, её плотность, обусловленная кулоновским взаимодействием.
Соли – электролиты, диссоциирующие в раств-х с образованием «+» заряженных ионов Ме и «-» заряженного кислотного остатка. Соли бывают: средние (нормальные), кислые(КНСО3), основные (Mg(OH)NO3), двойные (KAl(SO4) сульфат калия-алюминия, смешанные (СаCl2O (Cl-Ca-OCl) хлорид-гипохлорид кальция.Свойства: 1) соль + основание = новая соль и новое основание.FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl 2). Соль + кислота = новая соль + новая кислотаCaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 3). Соль + соль = 2 новые солиCuSO4 + BaCl2 = BaSO4↓ + CuCl2 4). Более активный Ме вытесняет менее активный из р-ра его солиCuSO4 + Fe = Cu + FeSO4 5). При нагревании разлагаются2KNO3 = 2KNO2 + O2;2Cu(NO3)2 =2 CuO + 4 NO2 + O2
Получение: Средние 1. металл + неметалл 2Fe+3Cl2=2FeCl3 2. Металл +кислота=соль +Водород Mg+2HCl=MgCl2+H23.Металл1+соль1=металл2+соль2 Zn+CuSo4=Cu+ZnSo4 4. Основной оксид + кислотный оксид =Соль CaO+CO2=CaCO3 5. Взаимодействие кислот с основными и амфотерными оксидами CuO+H2SO4=CuSO4+H2O. Кислые соли: 1. Неполная нейтрализация кислоты основанием. В реакции участвует избыток кислоты и недостаток основания H3PO4 + KOH=KH2PO4+ H2O 2. Средняя соль + кислота = Кислая соль CaCO3+CO2+H2O=Ca(HCO3)2. Основные соли: 1. Неполная нейтрализация основания кислотой (избыток основания + недостаток кислоты)= основная соль Fe(OH)3+HCl=Fe(OH)2Cl 2. Средняя соль1+щелочь=основная соль + средняя соль2 FeCl2+KOH=FeOHCl+KCl 3. Средняя соль + одноименное основание = основная соль CaSO4+Ca(OH)2=(CaOH)2SO4
Способы получения: взаимодействие кислот с основаниями, взаимодействия металлов с кислотами, взаимодействие кислот с основаниями и амфотерными оксидами, взаимодействие кислот с солями, взаимодействия оснований с кислотными оксидов, взаимодействия соли и соли, основными оксидами с кислотами, металлов с не металлами.
Применение: Ряд солей является соединениями необходимыми в значительных количествах для обеспечения жизнедеятельности животных и растительных организмов, в качестве высотемпературного понизителя вязкости буровых растворов(бихромат натрия).
Гидролиз – реакция обмена м\у растворенным в воде вещ-ом и водой, сопровождающимся изменением рН.
1. Соль образована сильным основанием и слабой кислотой(Na2CO3) – гидролиз по аниону, сводится к присоединениюН к ионам кислотного остатка и отщеплению гидроксид ионов от молекулы воды(среда щелочная, рН>7, фенолфталеин мальновый, лакмус синий) CO32− + H2O = HCO3− + OH−
Na2CO3 + Н2О = NaHCO3 + NaOH
2. Соль образ-а слабым основание и сильной кислотой (CuCl2)– гидролиз по катиону, сводится к присоединению ОН к ионам Ме и освобождению Н от молекулы воды. (среда кислая, фенолфт. не изменится, лакмус розовый, метилоранж розовый) Cu2+ + Н2О = CuOH++Н+; CuCl2 + Н2О = CuOHCl + HCl
3. Соль образована сильным основание и сильной кислотой(NaCl) – гидролиз не происходит, индикаторы окраску не меняют.
4. Соль образована слабым основание и слабой кис-ой (Al2S3) – гидролиз по катиону и аниону, гидролиз происходит нацело, и соль перестает существовать. Константа гидролиза — константа равновесия гидролитической реакции.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
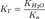 , где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
, где Ka — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
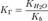 , где Kb — константа диссоциации слабого основания, образующегося при гидролизе
, где Kb — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием: 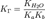
БИЛЕТ 8
|
|
Дата добавления: 2015-04-23; Просмотров: 789; Нарушение авторских прав?; Мы поможем в написании вашей работы!