
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов. Сильные и слабые электролиты. Степень и константа диссоциации. Закон разбавления Оствальда
|
|
|
|
Степень ионности и ковалентности связи. Природа связи в КС.
Комплексные соединения – такие соединения, которые при электролитической диссоциации образуют комплексный ион. Теория комплексных соединений – Альфред Вернер, 1913 г. Нобелевская премия. они образуются в результате насыщения химическими связями некоторых атомов, моединяющихся молекул или ионов, за счет их вакантных (акцепторы) или заполненных (доноры) орбиталей. Большинство комплексных частиц имеют явно выраженную «централизованную» структуру, т.е. содержат центральный атом, вокруг которого располагаются (координируются) связанные с ним частицы – атомы, ионы или молекулы. Центральный атом, называемый комплексообразователем, способен устанавливать хим. связь (иногда не 1) с каждой окружающей его частицей.Частицы, непосредственно связанные с комплексообразователем – лиганды.Комплексообразователь вместе с лигандами образует комплексную частицу, которую при написании заключают в квадратные скобки. Количество лигандов в ней определяется координационным числом – важнейшая характеристика компл. соед-я, пказывающая число атомов, связанных σ-связями, т.е. оно показывает число мест вокруг комплесооб-я, на которых могут размещаться лиганды.
Сильный электролит – соед-ие, которое в расплавленном состоянии или в растворе полностью ионизировано.
Слабый электролит – вещ-во, которое диссоциирует частично. Степень диссоциации – доля молекул, распавшихся на ионы, (N диссоциированных/N общее *100%). α >30% сильные электролиты, α<3% слабые электролиты.
Электролитическая диссоциация - самопроизвольный процесс распада электролита в растворе с образованием «+» и «-» заряженных ионов, или соответственно катионов и анионов. 1)Чем более полярен растворитель, тем больше степень диссоциации в нем данного электролита.
2)повышение температуры, как правило, увеличивает дисс-ию и при нагревании степень дисс-ии возрастает.
3)при уменьшении концентрации электролита, т.е. при его разбавлении, степень диссоциации увелиивается.
Электролиты, степень диссоциации которых даже в разбавленных растворах мала,- слабые (почти все органические кислоты, некоторые мин. кислоты: H2CO3, H2S, многие гидроксиды металлов).
Константа диссоциации слабых электролитов - это отношение произведения концентраций продуктов реакции к конц-ии реагентов.
Константа диссоциации – константа равновесия отвечающая диссоциации слабого электролита. Зависит от природы электролита и растворителя, температуры но не зависит от концентрации. Характеризует способность данного вещества распадаться на ионы. Чем больше К тем лучше в-во диссоциирует. Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Если выразить равновесные концентрации через концентрацию слабого электролита с и его степень диссоциации α, то получим Kд=(с*α) *(с* α)/с(1- α)=(с* α 2)/(1- α). Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:.
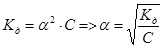 |
БИЛЕТ 6
1 .Периодический закон Д.И. Менделеева как основа развития неорганической химии. Структура периодической системы: периоды, группы и подгруппы. Периодическая система элементов и её связь со строением атома. Номенклатура основных классов неорганических соединений.
Периодический закон Д.И. Менделеева как основа развития неорганической химии: 1869 –Д.И.Менделеев открыл периодический закон: Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра их атомов
Структура период-ой системы хим. элементов Д.И. Менделеева:
Период.система Менделеева состоит из 7 периодов.
Период – горизон-ый ряд элементов, расположенных в порядке возрастания порядкового №..
Группы – вертик-ые ряды..
Подгруппы:Главные подгрупы (А) содержат элементы s- и p-электронных семейств, которые расположены и в больших и в малых периодах. s-элементы только металлы p-элементы Ме и неМе. Побочные подгруппы (В) содержат элементы d-электронных семейств.
Периодическая система элементов и её связь со строением атома
Каждый период начинается активным щелочным металлом и заканчивается инертным газом. В пределах периода с возрастанием поряд. № изменяются свой-ва элементов: * Метал. сво-ва ослабевают; *Неметал. сво-ва усиливаются; * Возрастает валентность по кислороду (от 1 до 8); *Уменьшение валентности по водороду (от 4 до 1, начиная с 4 группы);* Сво-ва соед-ий изменяются от основных через амфотерные к кислотным.
В пределах мал. периодов изменение сов-в идет быстрее, чем в больших. У элем-ов больших периодов сначала происходит заполнение не внешнего, а предвнеш. электр-го слоя При увел. числа ē увалич. сила Кулоновского взаимодействия.
№ группы определяет max валентность элемента, max положит-ую степень окисления, число валентных ē (исключения O и F
Только элементы А подгр.(начин. с 4) образуются летучие соед-я. В пределах А подгруппы металл-ие свойства ↑, а неметалл. ослабевают, т.к ↑ R атома и лёгкость отдачи ē. Самый активный Ме – Fr(франций),самый активный неМе – F(фтор).
Электроотрицательность - способность атомов присоединять электроны в химических соединениях с другими элементами. ЭО - в периоде увеличивается, а в группе уменьшается.
Ионы, имеющие одинаковое количество электронов – изоэлектронные.
Энергия ионизации – количество энергии, затрачиваемое при превращении атома в положительно заряженный ион. В периоде увеличивается, а в группе уменьшается.
Номенклатура основных классов неорганических соединений.
Оксиды – это сложные вещества, состоящие из атомов двух элементов, один из которых кислород в степени окисления «-2». Э2+хОх-2
Основания – сложные вещества, в состав которых входят атомы металла и гидроксогруппы OH-. Me+n(OH)n-1
Кислоты - это сложные вещества, в состав которых входят ионы водорода Н+, способные замещаться на металл, и кислотный остаток. Нn+ Х-n кислоты:1)
Бескиcлородные и. Кислородосодержащие.
Соли – это сложные вещества, состоящие из катионов металла и анионов кислотного остатка. 1)Средние (нормальные) – продукт полной нейтрализации кислоты основанием (продукт полного замещения ионов водорода Н+ ионами металла в кислоте. Примеры: NaCl, K2S, Ca(NO3)2, FeSO4, Fe2(SO4)32)Кислые - в которых атомы водорода не были полностью замещены.3) Основные – продуукт неполной нейтрализации основания.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!