
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теорема Клаузиуса
|
|
|
|
Неравенство Клаузиуса. Энтропия. Изменение энтропии при обратимых и необратимых процессах. Изменение энтропии в процессах идеального газа.
Рассмотрим обратимый процесс по пути 1а2 и 2б1. Т.к. процессе 1а2б1 обратимый, то для него справедливо равенство Клаузиуса 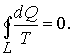
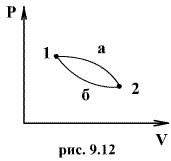 Разобьем этот интеграл на два: по пути 1а2 и 2б1
Разобьем этот интеграл на два: по пути 1а2 и 2б1 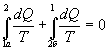 Поменяем пределы интегрирования второго интеграла
Поменяем пределы интегрирования второго интеграла 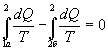 или
или 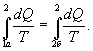 Таким образом, сумма приведенных теплот при переходе из одного состояния в другое не зависит от формы (пути) перехода в случае обратимых процессов. Последнее утверждение носит название теоремы Клаузиуса.
Таким образом, сумма приведенных теплот при переходе из одного состояния в другое не зависит от формы (пути) перехода в случае обратимых процессов. Последнее утверждение носит название теоремы Клаузиуса.
Если же 2б1 я-ся необратимым неравновесным способом то ΔS≥0 (интеграл 1а2 больше) неравенство клаузиуса. Изменение энтропии замкнутой системы может либо равняться улю или возрастать для необратимого процесса.
9.15 Энтропия Из теоремы Клаузиуса следует, что приведенная теплота подобно энергии (потенциальной, внутренней) является функцией состояния (не зависит от пути перехода и зависит только от состояния системы). Независимость интеграла 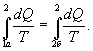 от пути перехода означает, что этот интеграл выражает собой изменение некоторой функции состояния системы, она называется энтропия и обозначается буквой S. Изменение энтропии системы, очевидно, равно
от пути перехода означает, что этот интеграл выражает собой изменение некоторой функции состояния системы, она называется энтропия и обозначается буквой S. Изменение энтропии системы, очевидно, равно 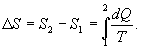 . Мы говорим только об изменении энтропии (подобно изменению потенциальной энергии
. Мы говорим только об изменении энтропии (подобно изменению потенциальной энергии  , для которой не важно где начало отсчета). Из уравнения что выше вытекает основное количественное выражение второго начала термодинамики
, для которой не важно где начало отсчета). Из уравнения что выше вытекает основное количественное выражение второго начала термодинамики
Энтропия 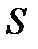 – это такая функция состояния, дифференциал которой определяется отношением:
– это такая функция состояния, дифференциал которой определяется отношением: 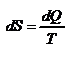 . В СИ энтропия
. В СИ энтропия 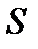 измеряется в Дж/К. Приведём формулы для подсчёта изменения энтропии в случае изопроцессов для идеального газа:
измеряется в Дж/К. Приведём формулы для подсчёта изменения энтропии в случае изопроцессов для идеального газа:
а) Изохорический процесс: 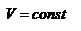
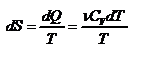 ,
, 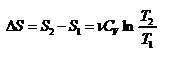 .
.
б) Изобарический процесс: 
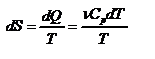 ,
, 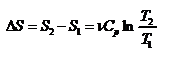 .
.
в) Изотермический процесс: 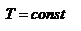
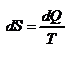 ,
, 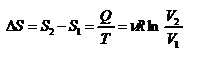 .
.
г) Адиабатический процесс: 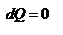
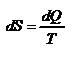 ,
,  ,
, 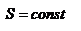 .
.
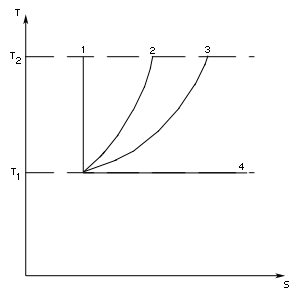
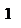 - адиабатический процесс,
- адиабатический процесс,
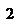 - изохорический процесс,
- изохорический процесс,
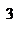 - изобарический процесс,
- изобарический процесс,
 - изотермический процесс.
- изотермический процесс.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 3025; Нарушение авторских прав?; Мы поможем в написании вашей работы!