
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса. Следствие закона Гесса
|
|
|
|
Билет №3
Растворы. Образование растворов. Способы выражения концентрации растворов.
Растворы – гомогенные системы переменного состава.
- газообразные (воздух)
- жидкие (нефть)
- твердые (чугун)
Растворитель и растворимые вещества= растворы
Если растворитель и растворимое вещество находятся в одной фазе, то раствор считается того вещества, которого больше.
Способ выражения концентрации растворов.
1. М – молярность.
По числу молей растворенного вещества в л раствора. Моль/л
2. N, н – нормальность г.эквив/л
По числу грамм эквивалента раствора вещества л раствора
3. m – маляльность
По числу молей растворенного вещества в 1 кг растворителя. Молей/1000г р-ля
4. % вес – число весовых частей растворенного вещества в 100 весовых частях раствора.
5. T – титр. г. раств. в-ва/см3
6. hi – мольная доля – отношение числа молей данного компонента к сумме молей всех компонентов раствора.
hi=hк/Shj
Теплота реакции является следствием того, что энергия продуктов реакции отличается от энергии реакции исходных веществ.
Реакции, в которых теплота выделяется (H2>H1) – экзотермические. Если наоборот, то эндотермические.
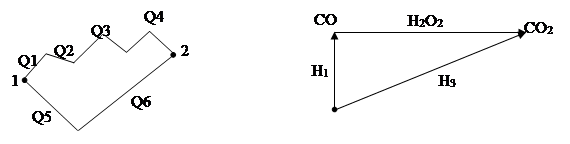 Тепловой эффект одного ряда последовательных химических реакций равен тепловому эффекту другого ряда последовательных химических реакций, если исходные вещества и продукты реакции одинаковы и процесс протекает либо при V=const, либо при P=const.
Тепловой эффект одного ряда последовательных химических реакций равен тепловому эффекту другого ряда последовательных химических реакций, если исходные вещества и продукты реакции одинаковы и процесс протекает либо при V=const, либо при P=const.
|
Q1+Q2+Q3+Q4=Q5+Q6
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 499; Нарушение авторских прав?; Мы поможем в написании вашей работы!