
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Рауля. Криоскопия и эбуллиоскопия
|
|
|
|
Третий закон термодинамики.
Расчет абсолютного значения энтропии. Третий закон термодинамики.
Билет №4
Для изолированных систем критерием самопроизвольного течения процесса является рост энтропии.
Энтропия (физический смысл). Каждое макросостояние осуществляется за счет бесчисленного числа микросостояний.
Больцман показал, что чем большее число микросостояний соответствует данному макросостоянию, тем больше термодинамическая вероятность системы, т.е абсолютное значение энтропии является функцией термодинамической вероятности W.
S=KLnW
K-постоянная Больцмана.
Энтропия – мера молекул состояния, мера хаотичности системы.
Sпара>Sжидкости>Sтверд.
Абсолютное значение энтропии всех веществ приводится в справочнике. Для расчета надо:
DS0р-ции=ånjDS0jпродукты-åniDS0iисх.в-в
[Дж/моль*К]
Энтропия идеального кристалла при 0град. К равна S=0.
Идеальный – кристалл, в котором атомы занимают узлы кристаллической решетки в строгом соответствии с геометрическими законами, т.е. одно возможное микросостояние реализует одно макросостояние.
Энтропия идеального кристалла при 0град.К служит точкой отсчета в шкале энтропии.
Равновесие смещается в том направлении, в котором ослабляется приложенное воздействие, которое уменьшает концентрацию кислорода в воде, за счет его испарения.
 (P01-P02)/P1=h2
(P01-P02)/P1=h2
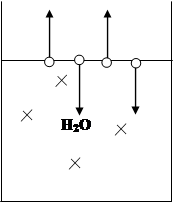
Рассмотрим чистый растворитель – вод. При определенной температуре на поверхности растворителя наступает момент динамического равновесия, при котором скорость испарения молекул воды равна скорости конденсации. Если в чистый растворитель добавить неэлектролит, то равновесие будет нарушено (концентрация воды в растворе станет меньше). Система отреагирует следующим образом: часть молекул воды из газообразной фазы перейдет в жидкую до тех пор, пока не восстановится равновесие.
Закон Рауля: относительное понижение P01 (давление насыщенного пара раствора над читсым растворителем) прямо пропорционально мольной доле растворенного вещества.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 485; Нарушение авторских прав?; Мы поможем в написании вашей работы!