
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ароматические углеводороды. Бензол, строение, свойства. Применение бензола и его гомологов
|
|
|
|
 Ароматические углеводороды – арены имеют общую формулу СnH2n-6, при условии, что n ≥6. Особенностью аренов является наличие бензольного кольца и ароматической связи.
Ароматические углеводороды – арены имеют общую формулу СnH2n-6, при условии, что n ≥6. Особенностью аренов является наличие бензольного кольца и ароматической связи.
- структурная формула первого представителя аренов – бензола, молекулярная формула С6Н6
Все электроны атомов углерода в молекуле бензола находятся в состоянии sp2-гибридизации, негибридные электроны образуют единую π-систему (ароматическую связь). Эту систему изображают в формуле в виде кольца.
Бензол это бесцветная жидкость со специфическим запахом. В воде не растворим. Сам бензол является хорошим растворителем для многих органических веществ. Горит коптящим пламенем, так как содержит большое количество углерода в молекуле.
Химические свойства:
+Cl2, Br2 (при участии катализаторов)- реакция замещения
+ HNO3 - реакция замещения
+ CH3Cl – алкирирование – образование толуола
+ СН2=СН2 – образование этилбензола (ксилола)
+Н2 (катализатор, давление и температура) – реакция присоединения, образование циклогексана
+ Сl2 (свет) – присоединение – образование гексахлорциклогексан (гексахлоран)
+ О2 – горит коптящим пламенем.
Применение
Бензол – растворитель и сырье для получения красителей, лекарств, ядохимикатов, фенола, анилина, стирола и многих других органических веществ.
Билет № 5
1. Основные положения теории химического строения органических веществ А.М.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекуле.
В своей теории Александр Михайлович Бутлеров обобщил опыт и знания ученых органиков того времени и объяснил строение молекул органических веществ. Это теория играет важную роль в объяснении строения и свойств всех органических веществ.
Основные положения теории химического строения веществ А.М. Бутлерова.
- Атомы в молекулах органических реально существуют. Доказательством служит получение искусственным путем органический веществ из неорганических.
- Соединения атомов в молекулах органических веществ происходит в определенной последовательности (валентность С – IV)
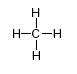
- Свойства вещества зависят от порядка соединения атомов в молекулах

4.По свойствам вещества можно определить его строение, а по строению - свойства.
5. Атомы и группы атомов взаимно влияют друг на друга. Доказать это можно на примере толуола: толуол как бензол вступает в реакцию замещения, но замещение происходит в положениях 2, 4, 6 – сказывается влияние СН3-радикала; толуол обесцвечивает раствор перманганат калия – сказывается влияние бензольного кольца на УВ-радикал
Билет №6
1. Изомерия органических веществ, ее виды.
Изомерия химических соединений, явление, существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связей между атомами в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
 Структурная изомерия подразделяется на несколько разновидностей.
Структурная изомерия подразделяется на несколько разновидностей.
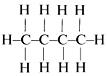
·  Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы.
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы.
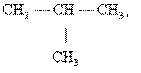
· Изомерия положения обусловлена различным положением какой-либо реакционноспособной группы (функциональной группы, заместителя) при одинаковом углеродном скелете молекул. Так, пропану соответствуют два изомерных спирта: н-пропиловый и изопропиловый:

Изомерия непредельных соединений может быть вызвана различным положением кратной связи, как, например, в бутене-1 и бутене-2:

Межклассовая изомерия – вещества одного состава могут принадлежать к разным классам органических соединений:
алкены изомерны циклоалканам
алкина – алкадиенам
предельные одноатомные спирты – простым эфирам
альдегиды – кетонам
карбоновые кислоты – сложным эфирам
аминокислоты - нитросоединениям
Пространственная изомерия подразделяется на два вида: геометрическую изомерию (или цис-транс-изомерию) и оптическую изомерию. Геометрическая изомерия свойственна соединениям, содержащим двойные связи (С = С, C = N и др.). В этих случаях заместители могут быть расположены либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Понятия «цис» и «транс» обычно относят к паре одинаковых заместителей, а если все заместители разные, то условно к одной из пар.
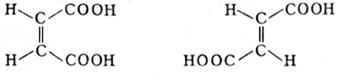
Геометрические изомеры обычно существенно различаются по физическим свойствам (температурам кипения и плавления, растворимости).
Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии (плоскости, разделяющей молекулу на две зеркально тождественные половины) и не совмещающимся со своим зеркальным отображением (т. е. с молекулой, соответствующей этому зеркальному отображению). Такие асимметричные молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через кристалл, расплав или раствор вещества.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 7909; Нарушение авторских прав?; Мы поможем в написании вашей работы!