
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет № 13. Кислород: состав молекулы, физические и химические свойства
|
|
|
|
Кислород: состав молекулы, физические и химические свойства
Молекула кислорода O2 состоит из двух атомов кислорода, связанных ковалентной неполярной связью.
Представление о наличии в молекуле кислорода двух ковалентных связей не соответствует, в частности, её магнитным свойствам (жидкий кислород притягивается магнитом), поэтому лучше не останавливаться на этом моменте. В высшей школе изучается метод Молекулярных орбиталей о наличии в молекуле кислорода двух неспаренных электронов.
Кислород – бесцветный прозрачный газ, без вкуса, без запаха. Немного тяжелее воздуха, сравнительно мало растворим в воде (в 1 литре воды при 20оC растворяется около 0,03 л кислорода).
Химические свойства:
Кислород активный окислитель. Многие вещества взаимодействуют с кислородом с выделением теплоты и света. Такие реакции называются горением:
1. S + O2 = SO2 (образуется оксид серы (IV), или сернúстый газ)
2. C + O2 = CO2 (образуется оксид углерода (IV), или углекислый газ)
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе, так как выделяющаяся теплота не тратится на нагревание азота воздуха. Температура горения в чистом кислороде значительно выше.
Галогены, золото и платина не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7.
Фторид кислорода O+2F2-1 – соединение, в котором кислород проявляет положительную степень окисления.
3. Железо горит в кислороде с образованием железной окалины (представляет из себя смешанный оксид Fe+2O•Fe2+3O3):
3Fe + 2O2 = Fe3O4
4. При пропускании через воздух электрических разрядов, или во время грозы кислород превращается в озон – аллотропное видоизменение, состоящее из трех атомов кислорода:
3O2 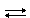 2O3
2O3
5. Пропитанные жидким кислородом угольный порошок, древесная мука и другие горючие материалы обладают взрывчатыми свойствами, используются при подрывных работах.
6. При участии кислорода в природе совершается важнейший процесс – дыхание. Транспорт кислорода из легких человека в ткани осуществляет гемоглобин крови, образующий комплекс с кислородом.
Кислород применяется
· в медицине при затрудненном дыхании,
· в металлургии,
· для газовой сварки и резки металлов и т.д.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1169; Нарушение авторских прав?; Мы поможем в написании вашей работы!