
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимость химических реакций, химическое равновесие
|
|
|
|
Билет 5.
Реакции, протекающие при данных условиях во взаимно противоположных направлениях, называются обратимыми.
N2 + 3H2 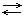 2NH3 + Q
2NH3 + Q
Одну из реакций называют прямой, другую обратной. В таких реакциях концентрация реагирующих веществ уменьшается, следовательно, уменьшается скорость прямой реакции. При этом скорость обратной реакции постепенно увеличивается, наступает химическое равновесие, при котором скорость прямой реакции равна скорости обратной реакции. Это значит: сколько молекул образуется в единицу времени, столько и расходуется.
Состояние химического равновесия при неизменных условиях сохраняется длительное время. При изменении условий (t, давления (P) и концентрации (C)) состояние равновесия нарушается. Смещение химического равновесия определяется по принципу Ле Шателье: если на систему находящуюся в равновесии оказывать какое-либо воздействие, то равновесие смещается в направление ослабления этого воздействия.
Если реакции идёт с выделением тепла, то при повышении t равновесие смещается в направление « » и наоборот «
» и наоборот « ».
».
[Если + Q и t  , то
, то  ]
]
Если с уменьшением объёма (V), то при повышении давления (P) равновесие смещается в направлении  и наоборот
и наоборот  .
.
N2 + 3H2 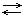 2NH3 + Q
2NH3 + Q
1V 3V 2V
всегда к меньшему объёму, если V 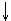
При увеличении концентрации (C) исходных веществ равновесие смещается в сторону  прямой реакции и наоборот
прямой реакции и наоборот  .
.
[Если С  , то
, то  ]
]
если увел. С прод. реакции, то 
если умен. С прод. реакции, то  .
.
2. Ацетилен…
Ацетиле́н — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов.
Атомы углерода в ацетилене sp-гибридизованы. Они связаны одной 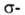 и двумя
и двумя  связями, макс. плотности к-рых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облако
связями, макс. плотности к-рых расположены в двух взаимно перпендикулярных областях, образуя цилиндрич. облако 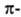 электронной плотности; за его пределами находятся атомы Н (см. рис.).
электронной плотности; за его пределами находятся атомы Н (см. рис.).
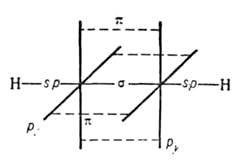
Молекула ацетилена линейна; все 4 атома расположены на прямой. Расстояния С  С и С—Н равны соотв. 0,1205 и 0,1059 нм.
С и С—Н равны соотв. 0,1205 и 0,1059 нм.
Для ацетилена характерны р-ции присоединения, к-рые происходят в две стадии: сначала образуются замещенные этилена, затем - замещенные алканов. Галогены присоединяются непосредственно, галогеноводороды - в присут. катализаторов (напр., CuCl, HgCl2):

Эти р-ции используются при произ-ве тетрахлорэтилена, трихлорэтилена, винилхлорида и др. хлорсодержащих соединений.
. Гидрирование. Реакция протекает в тех же условиях, что и в случае алкенов (катализаторы Pt, Pd, Ni). При восстановлении алкинов вначале образуются алкены, а затем — алканы:
H2 H2
HC≡CH —→ H2C=CH2 —→ H3C—CH3
ацетилен этилен этан
Гидрогалогенирование. Реакции присоединения галогеноводородов, как и галогенов, идут в основном по механизму электрофильного присоединения:
HCl
HCє≡CH + HCl —→ H2C=CHCl —→ H3C—CHCl2
хлорэтен 1,1-дихлорэтан
(хлористый винил)
Вторая молекула галогеноводорода присоединяется в соответствии с правилом Марковникова.
Присоединение воды (реакция М.Г.Кучерова,. 1881). Катализатор — соль ртути:
HgSO4
HC≡CH + HOH ——→ H2C=CH—OH →H3C—C=O
\ H
виниловый уксусный
спирт альдегид
(промежуточный
неустойчивый продукт)
Неустойчивое промежуточное соединение — виниловый спирт — перегруппировывается в уксусный альдегид.
При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.

| + | 
| ––600°C,C® | 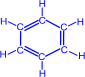
|
При полном сгорании ацетилена на воздухе образуются два продукта оксид углерода (IV) и вода:
2НС≡СН + 5O2 → 4СO2 + 2Н2O
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 862; Нарушение авторских прав?; Мы поможем в написании вашей работы!