
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения
|
|
|
|
Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
Ароматические углеводороды (арены)
Катализ и катализаторы
Билет 6.
ПОЛУЧЕНИЕ
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
1. Высокотемпературным разложением (крекинг) природного газа — метана:
2СН4 1500°C → НС≡СН + 3Н2
или этана:
С2Н6 1200°C → НС≡СН + 2Н2
2. Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C →CaC2 + CO
СаС2 + 2Н2O → НС≡СН + Са(ОН)2
1. Скорость химических реакций
Химические реакции могут протекать в гомогенной (однородной) среде и гетерогенной (неоднородной) среде.
Скорость гомогенной реакции определяется изменением количества вещества вступившего в реакцию или образующегося в результате реакции за единицу времени в единицу объёма.
Если реакция едёт в гетерогенной среде, то соприкасаются между собой только вещества находящиеся на поверхности. Скорость гетерогенной реакции определяется изменением количества вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единицу поверхности.
На скорость химической реакции влияют следующие факторы:
- Природа реагирующих веществ.
Na + H2O à мгновенная реакция
Mg + H2O à медленная реакция
- Для газов и растворов скорость зависит от концентрации реагирующих веществ.
С увеличением концентрации скорость реакции увеличивается, так как число столкновений между молекулами возрастает.
- Для веществ в твёрдом состоянии скорость зависит от поверхности реагирующих веществ. С измельчением вещества скорость реакции увеличивается.
- При повышении t скорость реакции увеличивается, так как возрастает доля активных молекул.
- Скорость реакции зависит от присутствия катализаторов или ингибиторов.
В ускорении химических реакций исключительно большая роль принадлежит катализаторам, например, при производстве H2SO4, NH3, HNO3, этанола, этаноля и других веществ.
Явление ускорения химических реакций благодаря присутствию некоторых веществ носит название катализа, замедления – ингибирования.
Вещества, которые ускоряют химические реакции, активно участвуют в них, но сами в итоге не расходуются, называются катализаторами.
Вещества, которые замедляют скорость химических реакций, называются ингибиторами.
Реакции, протекающие под действием катализаторов, называются каталитическими.
Понятие “бензольное кольцо” требует расшифровки. Для этого необходимо рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865г. немецким ученым А. Кекуле:

Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т. е. не дает типичных для непредельных соединений качественных реакций.
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует s -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя s -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (s -скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому s -скелету и параллельно друг другу (см. рис. а). Все шесть электронов взаимодействуют между собой, образуя p -связи, не локализованные в пары как при образовании двойных связей, а объединенные в единое p -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. Наибольшая p -электронная плотность в этой сопряженной системе располагается над и под плоскостью s -скелета (см. рис. б).

В результате все связи между атомами углерода в бензоле выровнены и имеют длину 0,139нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154нм) и длиной двойной связи в алкенах (0,133 им). Равноценность связей принято изображать кружком внутри цикла (см. рис. в). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения, — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
1. Получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее шести атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидроциклизация — образование арена с выделением водорода:

2. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:
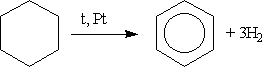
3. Получение бензола тримеризацией ацетилена.
4. Получение гомологов бензола по реакции Фриделя—Крафтса (см. далее).
5. Сплавление солей ароматических кислот со щелочью:

Химические свойства бензола. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:
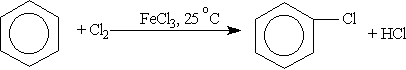
Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:

2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
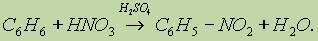
3. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан, а гомологи бензола — в производные циклогексана:

7. Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 816; Нарушение авторских прав?; Мы поможем в написании вашей работы!