
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграмма состояния сплавов I типа. Правило фаз и отрезков
|
|
|
|
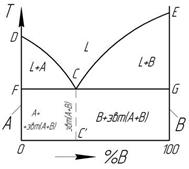 структурные области диаграмм структурные области диаграмм
|
По диаграмме I типа кристаллизуются сплавы, компоненты которых по своей природе имеют след. св-ва: 1) в жидком состоянии обладают неограниченной взаимной растворимостью: 2) не образуют твердых растворов: при переходе сплава из жидкого состояния в твердое 3) не образуют химических соединений: при расплавлении и последующей кристаллизации сплава компоненты не входят друг с другом в химическое взаимодействие. Таким образом, диаграмма состояния I типа соответствует сплавам, компоненты которых в жидком состоянии неограниченно растворяются друг в друге, а в твердом - образуют механическую смесь
В соответствии с этой диаграммой плавятся и затвердевают многие металлические сплавы, например системы Pb-Sb, Sn-Zn, Ag-AI и др.
В процессе кристаллизации меняется фазовый состав сплава. Двойные диаграммы позволяют определить количество фаз в двухфазных областях диаграммы для каждой фигуративной точки сплава.
Первое положение правила отрезков: чтобы определить концентрации компонентов в фазах, через данную точку, хар-щую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывают составы фаз.
Второе положение правила отрезков: для того, чтобы определить количественное соотношение фаз через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Правило фаз — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе.
Правило фаз записывается следующим образом:

где j — число фаз (например, агрегатных состояний вещества);
v — число степеней свободы, то есть независимых параметров (температура, давление, концентрация компонентов), которые полностью определяют состояние системы при равновесии и которые можно менять без изменения числа и природы фаз;
k — число компонентов системы — число входящих в систему индивидуальных веществ за вычетом числа химических уравнений, связывающих эти вещества. Иначе говоря, это минимальное количество веществ, из которых можно приготовить каждую фазу системы.
n — число переменных, характеризующих влияние внешних условий на равновесие системы.
При переменных давлении и температуре правило фаз сводится к выражению:
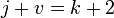
В случае однокомпонентной системы оно упрощается до:
 ,
,
Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.
Иногда правило фаз записывают следующим образом:
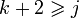
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 901; Нарушение авторских прав?; Мы поможем в написании вашей работы!