
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Протекают до конца
|
|
|
|
Условия, при которых реакции ионного обмена
Правила написания уравнений реакций в ионном виде
Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ, обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
1. Если в результате реакции выделяется малодиссоциирующее вещество – вода.
Молекулярное уравнение реакции щелочи с кислотой:
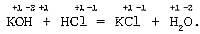
Неизменность степеней окисления элементов во всех веществах до и после реакции говорит о том, что реакции обмена не являются окислительно-восстановительными.
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O.
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O.
2. Если в результате реакции выделяется нерастворимое в воде вещество.
Молекулярное уравнение реакции растворимой соли со щелочью:
CuCl2 + 2KOH = 2KCl + Cu(OH)2.
Полное ионное уравнение реакции:
Cu2+ + 2Cl– + 2K+ + 2OH– = 2K+ + 2Cl– + Cu(OH)2.
Cокращенное ионное уравнение реакции:
Cu2+ + 2OH– = Cu(OH)2.
3. Если в результате реакции выделяется газообразное вещество.
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S.
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S.
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S.
10) По химическим свойствам оксиды подразделяют на следующие типы:
основные — им соответствуют основания;
амфотерные — им соответствуют амфотерные гидроксиды, которые сочетают свойства оснований и кислот;
кислотные — им соответствуют кислоты;
несолеобразующие или безразличные— они не имеют своих гидроксидов и не вступают в реакции обмена (запомните их формулы: N2О, NO, CO, SiO и др.);
вода — занимает особое положение, по своим свойствам она является одновременно и амфотерным, и несолёобразующим оксидом.
Существуют соединения элементов с кислородом, которые не считаются оксидами. Например, пероксид водорода Н2О2; фторид кислорода OF2 — тоже не оксид.
Оксидами же называются сложные вещества, состоящие из двух элементов, один из которых кислород, т.е. оксид - это соединение элемента с кислородом.
Название оксидов образуется от названия элемента, входящего в состав оксида. Например, BaO - оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой. Например, FeO - оксид железа (I), Fe2О3 - оксид железа (III).
Элементы, обладающие постоянной валентностью, образуют только основные, кислотные или амфотерные оксиды. Элементы с переменной валентностью могут образовывать различные оксиды.
Все оксиды делятся на солеобразующие и несолеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота N2O (I), оксид азота NO (II).
По своим химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H2SO4 = CuSO4 + H2O
Растворимые в воде основные оксиды вступают в реакцию с водой, образуя основания:
CaO + H2O = Ca(OH)2
Большинство основных оксидов с водой не взаимодействуют, но им также соответствуют основания, которые можно получить косвенным путем.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na2O + SO3 = Na2SO4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B2O3; N2O5).
Многие кислотные оксиды соединяются с водой, образуя кислоты:
N2O3 + H2O = 2HNO2
SO3 + H2O = H2SO4
Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.
Кислотные оксиды реагируют с основными оксидами с образованием соли:
CO2 + CaO = CaCO3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + Ba(ОН)2= BaCO3 + H2O
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например - Al2O3, Cr2O3, MnO2; Fe2O3, ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O
Так как далеко не все амфотерные оксиды расворимы в воде, то доказать амфотерность таких оксидов заметно сложнее. Например, оксид алюминия (III) в реакции сплавления его с дисульфатом калия проявляет основные свойства, а при сплавлении с гидроксидами кислотные:
Al2O3 + 3K2S2O7 = 3K2SO4 + A12(SO4)3
Al2O3 + 2KOH = 2KAlO2 + H2O
У различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) - Fe2O3 - обладает преимущественно основными свойствами.
Способы получения оксидов из простых веществ - это либо прямая реакция элемента с кислородом:
2Ca + O2 = 2CaO
либо разложение сложных веществ:
а) оксидов
4CrO3 = 2Cr2O3 + 3O2
б) гидроксидов
Ca(OH)2 = CaO + H2O
в) кислот
H2CO3 = H2O + CO2
г) солей
CaCO3 = CaO +CO2
А также взаимодействие кислот - окислителей с металлами и неметаллами:
Cu + 4HNO3(конц) = Cu(NO3) 2 + 2NO2 + 2H2O
11) Кислота – это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
С точки зрения теории электролитической диссоциации, кислота – это электролит, который при растворении в воде диссоциирует на катионы водорода и анион кислотного остатка.
Кислоты классифицируют по таким признакам: а) по наличию или отсутствию кислорода в молекуле и б) по числу атомов водорода.
По первому признаку кислоты делятся на кислородсодержащие и бескислородные (табл. 8-1).
Таблица 8-1. Классификация кислот по составу.
| Кислородсодержащие кислоты | Бескислородные кислоты |
| H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
По количеству атомов водорода, способных замещаться на металл, все кислоты делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н), как показано в табл. 8-2:
Таблица 8-2. Классификация кислот по числу атомов водорода.
| Одноосновные | Двухосновные | Трехосновные |
| HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O
Рассмотрим важнейшие химические свойства кислот.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
Индикаторы представляют собой вещества сложного строения. В растворах оснований и в нейтральных растворах они имеют иную окраску, чем в растворах кислот. Об индикаторах мы более подробно расскажем в следующем параграфе на примере их реакций с основаниями.
2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода.
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH: H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O
3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
Например, фосфорную кислоту используют для очистки железа от ржавчины (оксидов железа). Фосфорная кислота, убирая с поверхности металла его оксид, с самим железом реагирует очень медленно. Оксид железа превращается в растворимую соль FePO4, которую смывают водой вместе с остатками кислоты.
4. Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, ртуть и некоторые другие металлы с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла. По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов (табл. 8-3). Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами
Табл. 8-3. Ряд активности металлов.
| Металлы, которые вытесняют водород из кислот | Металлы, которые не вытесняют водород из кислот |
| Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) самые активные металлы | Cu Hg Ag Pt Au самые неактивные металлы |
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части табл. 8-3. Под силой кислоты понимают ее способность отдавать ионы водорода H+.
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами из левой части табл. 8-3.
В связи с этим существует еще одна классификация кислот – по силе. В таблице 8-4 в каждой из колонок сила кислот уменьшается сверху вниз.
Таблица 8-4. Классификация кислот на сильные и слабые кислоты.
| Сильные кислоты | Слабые кислоты |
| HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная | HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
** Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель – азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N+5, а не H+, как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S+6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Cu + 4 HNO3(конц.) =Cu(NO3)2 + 2 NO2 + 2 H2O
3 Cu + 8HNO3(разб.) = 3 Cu(NO3)2 + 2 NO + 4 H2O
8 K + 5 H2SO4(конц.) = 4 K2SO4 + H2S + 4 H2O
3 Zn + 4 H2SO4(конц.) = 3 ZnSO4 + S + 4 H2O
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Продукты окисления, образующие прочные пленки, могут растворяться в водных растворах кислот, но нерастворимы в кислотах концентрированных.
1. Бескислородные кислоты могут быть получены непосредственным синтезом из элементов, с последующим растворением полученного соединения в воде:
H2 + Cl2 = 2HCl
H2 + S = H2S.
2. Кислородсодержащие кислоты могут быть получены взаимодействием кислотных оксидов (ангидридов кислот) с водой:
SO3 + H2O = H2SO4
N2O5 + H2O = 2HNO3
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакции обмена между солями и другими кислотами:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3
AgNO3 + HCl = AgCl + HNO3
12) Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами-ОН. Общая формула:

По номенклатуре основания называют гидроксидами:
Формула Название Формула Название
LiOH гидроксид лития Ca(OH)2 гидроксид кальция
NaOH гидроксид натрия Cu(OH)2 гидроксид меди(II)
KOH гидроксид калия Fe(OH)2 гидроксид железа(III)
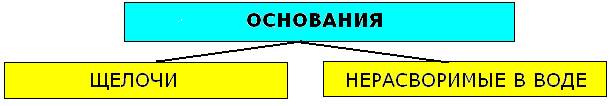
К щелочам относят гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.Остальные - нерастворимые.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью-как кислоты.
Получение оснований. Щелочи
1.Металл+вода
2Na+H2O=2NaOH+H2
Ba+2H2O=Ba(OH)2+H2
2.Оксид+вода
Li2O+H2O=2LiOH
CaO+H2O=Ca(OH)2
3.Электролиз растворов щелочных металлов 2NaCl+2H2O=2NaOH+Cl2+H2
Нерастворимые основания
Соль+щелочь CuSO4+2NaOH=Cu(OH)2+Na2SO4
Химические свойства оснований.
| Щёлочи | Нерастворимые основания |
| 1.Взаимодействие с кислотами KOH+HCl=KCl+H2O | Cu(OH)2+2HCl=CuCl2+2H2O |
| 2.Взаимодействие с кислотными оксидами 2KOH+CO2=K2CO3+H2O | не характерны |
| 3.Действие индикаторов лакмус-синяя, фенолфталеин-малиновая | окраска не изменяется |
| 4.Взаимодействие с амфотерными оксидами 2KOH+ZnO=K2ZnO2+H2O | не реагируют |
| 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание NaOH+CuCl2=Cu(OH)2 +2NaCl | не реагируют |
| 6.При нагревании не разлагаются(кроме LiOH) | Cu(OH)2=CuO+H2O |
| Zn(OH)2+2HCl=ZnCl2+2H2O | Al(OH)3+NaOH=Na[Al(OH)4] |
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 608; Нарушение авторских прав?; Мы поможем в написании вашей работы!