
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды азота 3 страница
|
|
|
|
H2S + Br2 → S+ 2HBr
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
3H2S + 8HNO3(конц) → 3H2S+6O4 + 8NO + 4H2O
H2S + H2SO4(конц) → S + SO2 + 2H2O
4) Сероводород окисляется:
при недостатке O2
2H2S + O2 → 2S + 2H2O
при избытке O2
2H2S + 3O2 → 2SO2 + 2H2O
5) Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
6) Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2 → PbS + 2HNO3
Na2S + Pb(NO3)2 → PbS¯+ 2NaNO3
Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются в PbS.
7) Реставрация:
PbS + 4H2O2 → PbSO4(белый) + 4H2O
ОКСИДЫ СЕРЫ
Оксид серы IV
SO2 (сернистый ангидрид; сернистый газ)
Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде; t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
Получение
1) При сжигании серы в кислороде:
S + O2 → SO2
2) Окислением сульфидов:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами:
Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой:
Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
Химические свойства
1) Сернистый ангидрид - кислотный оксид. При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе)
H2SO3 образует два ряда солей - средние (сульфиты) и кислые (бисульфиты, гидросульфиты).
Ba(OH)2 + SO2 → BaSO3 (сульфит бария) + H2O
Ba(OH)2 + 2SO2 → Ba(HSO3)2(гидросульфит бария)
2) Реакции окисления (S+4 – 2ē → S+6)
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 → 2Na2SO4
3) Реакции восстановления (S+4 + 4ē → S0)
SO2 + С → S + СO2
SO2 + 2H2S → 3S + 2H2O
Оксид серы VI
SO3 (серный ангидрид)
Физические свойства
Бесцветная летучая жидкость, t°пл. = 17°C; t°кип. = 66°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах).
SO3 + H2O → H2SO4
Твердый SO3 существует в трех модификациях. SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом.
Получение
1) 2SO2 + O2 →2SO3
2) Fe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства
1) Серный ангидрид - кислотный оксид. При растворении в воде дает сильную двухосновную серную кислоту:
SO3 + H2O → H2SO4
H2SO4 образует два ряда солей - средние (сульфаты) и кислые (гидросульфаты):
2NaOH + SO3 → Na2SO4 + H2O
NaOH + SO3 → NaHSO4
2) SO3 - сильный окислитель.
25) СЕРНАЯ КИСЛОТА - H2SO4
Физические свойства
Тяжелая маслянистая жидкость ("купоросное масло"); r = 1,84 г/см3; нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, очень гигроскопична, обладает водоотнимающими свойствами (обугливание бумаги, дерева, сахара).
Химические свойства
H2SO4 - сильная двухосновная кислота
H2SO4 ↔ H+ + HSO4- ↔2H+ + SO42-
Первая ступень (для средних концентраций) приводит к 100%-ой диссоциации:
K2 = ([H+] • [SO42-]) / [HSO4-] = 1,2 • 10-2
1) Взаимодействие с металлами:
a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода:
Zn0 + H2SO4(разб) → ZnSO4 + H2O
b) концентрированная H2SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
2Ag0 + 2H2SO4 →Ag2SO4 + SO2 + 2H2O
8Na0 + 5H2SO4 → 4Na2SO4 + H2S + 4H2O
2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2):
С + 2H2SO4(конц) → CO2 + 2SO2 + 2H2O
S + 2H2SO4(конц) → 3SO2 + 2H2O
2P + 5H2SO4(конц) → 5SO2 + 2H3PO4 + 2H2O
3) с основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
4) с гидроксидами:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
5) обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4 + 2HCl
Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов
MgCO3 + H2SO4 → MgSO4 + H2O + CO2
26) К главной подгруппе V группы периодической системы принадлежат p-элементы: азот N, фосфор P, мышьяк As, сурьма Sb и висмут Bi. Атомы этих элементов имеют на внешнем энергетическом уровне по пять электронов - ns2np3.
Наличие трех неспаренных электронов на внешнем энергетическом уровне объясняет то, что в нормальном, невозбужденном состоянии валентность элементов подгруппы азота равна трем.
Внешний уровень азота состоит только из двух подуровней - 2s и 2p. Атом азота может отдать с 2s-подуровня один электрон другому атому с большей электроотрицательностью и перейти в четырехвалентный ион N+.
У атомов остальных элементов подгруппы азота на внешних энергетических уровнях имеются вакантные ячейки d-подуровня, поэтому они могут распарить один электрон с s-подуровня и перенести его на d-подуровень. Таким образом, валентность фосфора, мышьяка, сурьмы и висмута равна 5.
Элементы группы азота образуют с водородом соединения состава RH, а с кислородом оксиды вида - R2O3 и R2O5. Оксидам соответствуют кислоты HRO2 и HRO3 (и ортокислоты H3PO4, кроме азота).
Высшая степень окисления этих элементов равна +5, а низшая -3.
В подгруппе азота с ростом порядкового номера неметаллические свойства убывают, а металические усиливаются. Азот - неметалл, висмут - металл. От азота к висмуту прочность соединений RH3 уменьшается, а прочность кислородных соединений возрастает.
АЗОТ
:NºN:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе).
В молекуле имеются одна s- и две p- связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием:
6Li + N2 → 2Li3N,
при нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды:
3Mg + N2 → Mg3N2,
2B + N2 →2BN,
Наибольшее практическое значение имеет нитрид водорода (аммиак):
27) АММИАК -NH3
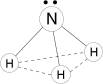
Строение
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.
Физические свойства
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха.
t° кип.= -33,4°C; t°пл.= -78°C.
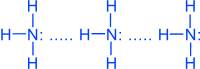
Молекулы аммиака связаны слабыми водородными связями
Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается.
Получение
1. Промышленный способ
N2 + 3H2 → 2NH3
(p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
2. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH → K2SO4 + 2NH3 + 2Н2O
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.
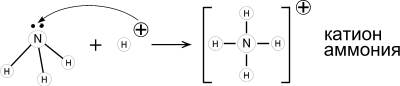
1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония.
NH3 + Н2O ↔ NH4OH ↔ NH4+ + OH-
2. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl → NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
NH3 + H2O + CO2 → NH4 HCO3
Аммиак - восстановитель (окисляется до N2+1O или N+2O)
1. Разложение при нагревании
2NH3 → N2+ 3H2
2. Горение в кислороде
a) без катализатора
4NH3 + 3O2 → 2N2 + 6Н2O
b) каталитическое окисление (kat = Pt)
4NH3 + 5O2 → 4NO + 6Н2O
3. Восстановление оксидов некоторых металлов
3CuO + 2NH3 → 3Cu0 + N20 + 3Н2O
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 → NH4NO3(нитрат аммония)
2NH4OH + H2SO4 →(NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl ↔ NH4+ + Cl-
2. Разложение при нагревании.
a) если кислота летучая
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + Н2O + CO2
b) если анион проявляет окислительные свойства
NH4NO3 → N2O + 2Н2O
(NH4)2Cr2O7 → N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
a) (NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+→ Н2O + CO2
b) (NH4)2SO4 + Ba(NO3)2 → BaSO4+ 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4+ 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH → NaCl + NH3 + Н2O
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5–1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Оксид азота (I)
N2+1O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С. Анестезирующее средство.
Получение
NH4NO3 → N2O + 2Н2O
Химические свойства
1. Разлагается при 700°C с выделением кислорода:
2N2O → 2N2 + O2
поэтому он поддерживает горение и является окислителем
2. С водородом:
N2O + H2 → N2 + Н2O
3. Несолеобразующий
Оксид азота (II)
N+2O окись азота
Газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
Получение
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 → 4NO + 6H2O
2. 3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
3. N2 + O2 →2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом и галогенами
2NO + O2 → 2NO2
2NO + Cl2 → 2NOCl(хлористый нитрозил)
2. Окислитель
2NO + 2SO2→ 2SO3 + N20
3. Несолеобразующий
Оксид азота (III)
N2+3O3 азотный ангидрид
Физические свойства
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
NO2 + NO → N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH → 2NaNO2(нитрит натрия) + H2O
Оксид азота (IV)
N+4O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
1. 2NO + O2 → 2NO2
2. Cu + 4HNO3(конц.) →Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид с водой
2NO2 + H2O → HNO3 + HNO2
4NO2 + 2H2O + O2 → 4HNO3
со щелочами
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
2. Окислитель
NO2 + SO2 → SO3 + NO
3. Димеризация
2NO2(бурый газ)«N2O4(бесцветная жидкость)
Оксид азота (V)
N2+5O5 азотный ангидрид
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
1. 2NO2 + O3→ N2O5 + O2
2. 2HNO3 +P2O5 → 2HPO3 + N2O5
Химические свойства
1. Кислотный оксид
N2O5 + H2O → 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании - со взрывом):
2N2O5 → 4NO2 + O2
29) Азотная кислота - HNO3
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO3+H2SO4(к)=NaHSO4+HNO3 Реакция протекает при слабом нагревании.
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха:
1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II):
4NH3 + 5O2=4NO+6Н2О
2. При охлаждении происходит дальнейшее окисление NO до NO2: 2NO+O2=2NO2
3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О2 с образованием HNO3: 4NO2+2Н2O+O2=4HNO3
Исходные продукты — аммиак и воздух — тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.).
Образующаяся кислота является разбавленной (40-60% -ной). Концентрированную азотную кислоту (96-98% -ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота.
Физические свойства
Азотная кислота — бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. При -41,6°С переходит в кристаллическое состояние. Кипит при 82,6°С.
В HNO3 валентность азота равна 4, степень окисления +5. Структурную формулу азотной кислоты изображают так:
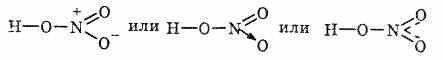
Оба атома кислорода, связанные только с азотом, равноценны: они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т.е. четвертая часть азота разделена поровну между двумя атомами кислорода.
Химические свойства
1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует: HNO3↔ Н++NO-3 Под действием теплоты и на свету частично разлагается:
4HNO3=4NO2+2Н2O+O2. Поэтому хранят ее в прохладном и темном месте.
2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3:
Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме.

Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты.
Примеры:

3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» — смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
Au+НNO3+3НСl= AuСl3+NO+2Н2О
3Pt+4HNO3+12НСl=3PtCl4+4NO+8H2O
Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора:
HNO3+HCl=Сl2+2Н2О+NOCl
Выделяющийся хлор соединяется с металлами.
4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO2:
S+6НNO3(конц)=H2SO4+6NO2+2Н2О
Р+5НNO3(конц)=Н3РO4+5NO2+Н2О
I2+10HNO3(конц)=2HIO3+10NO2+4Н2О
3Р+5HNO3(pазб)+2Н2О= 3Н3РО4+5NO
5. Она также взаимодействует с органическими соединениями.
Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO3 на металлы, их оксиды и гидрокси-ды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO3 применяют для приготовления черного пороха (смесь 75% KNO3, 15% С и 10% S). Из NH4NO3, порошка алюминия и тринитротолуола изготавливают взрывчатое вещество аммонал.
Соли азотной кислоты при нагревании разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:

Разложение при нагревании (термолиз) — важное свойство солей азотной кислоты.
2KNO3=2KNO2+O2
2Cu(NO3)2=2CuO+NO2+O2
Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu — оксид металла, NO2 и кислород, после Си — свободный металл, NO2 и кислород.
Применение
Азотная кислота — важнейший продукт химической промышленности. Большие количества расходуются на приготовление азотных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон и др. материалов. Дымящая азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
Соли азотной кислоты – нитраты
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:

Особое положение занимает нитрат аммония, разлагающийся без твердого остатка:
NH4NO3 (кр.) → N2O + 2H2O.
Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O — при сплавлении.
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH00:

Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
30) Металлы составляют большую часть химических элементов. Каждый период периодической системы (кроме 1-го) химических элементов начинается с металлов, причем с увеличением номера периода их становится все больше. Если во 2-м периоде металлов всего 2 (литий и бериллий), в 3-м — 3 (натрий, магний, алюминий), то уже в 4-м — 13, а в 7-м — 29.
Атомы металлов имеют сходство в строении внешнего электронного слоя, который образован небольшим числом электронов (в основном не больше трех).
Это утверждение можно проиллюстрировать на примерах Na, алюминия А1 и цинка Zn. Составляя схемы строения атомов, по желанию можно составлять электронные формулы и приводить примеры строения элементов больших периодов, например цинка.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2762; Нарушение авторских прав?; Мы поможем в написании вашей работы!