
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиды азота 2 страница
|
|
|
|
Fе + 2 НС1 = FеС12 + Н2
СuО + 2 НСl = СuСl2 + Н2О
ZnO + 2 НСl = ZnС12 + Н2О
Fе(ОН)3 + 3 НСl = FеСl3 + 3 H2О
АgNО3 + НСl = АgCl + НNО3
Nа2СO3 + 2 НCl = 2 NаСl + Н2О + СО2
Кроме свойств, присущих сильным кислотам, эта кислота характеризуется также восстановительными свойствами: концентрированная соляная кислота реагирует с различными сильными окислителями с образованием свободного хлора.
Соли соляной кислоты называются х л о р и д а м и. Большинство из них хорошо растворяется в воде и полностью диссоциирует на ионы. Слабораствориными являются хлорид свинца РbСl2, хлорид серебра AgCl, хлорид ртути (I) Нg2Сl2 (каломель) и хлорид мели (I) СuСl.
Cолянyю кислоту получают растворением хлороводорода в воде. Этот процесс осуществляют в специальных поглотительных башнях, в которых жидкость подается сверх вниз, а газ — снизу вверх (принцип противотока). В такой башне свежие порции воды в верхней части башни встречаются с газовым потоком, содержащим уже мало хлороводорода, а газ с высоким содержанием хлороводорода в нижней части башни встречается с концентрированной соляной кислотой. Так как растворимость газа в жидкости прямо пропорциональна концентрации его в газовой фазе и обратно пропорциональна концентрации его в растворе, при этом методе достигается полное извлечение хлороводорода из газа и получение концентрированного раствора соляной кислоты. Насыщенный при комнатной температуре водный раствор хлороводорода может содержать не более 42 масс. % хлороводорода и его плотность не превышает 1,20 г/см3. Поступающая в продажу соляная кислота содержит 36-37 хлороводорода и имеет плотность 1,19 г/см3.
Соляную кислоту хранят и транспортируют в стальных цистернах, покрытых изнутри кислотоупорной резиной, или в стеклянных баллонах.
Хлороводород, соляная кислота и ее соли широко используют в промышленности и лабораторной практике. Хлороводород применяют в органическом синтезе для получения хлорорганических соединений. Соляную кислоту используют для получения солей, травления металлов, а также как реактив в химических лабораториях.
Из солей соляной кислоты наибольшее применение находит:
каменная, или поваренная, соль NаС1. Она используется как сырье для получения хлора, металлического натрия, едкого натра, хлороводорода и соды, а также в пищевой промышленности;
хлорид калия КС1. Применяется как калийное удобрение, а также как сырье для получения других солей калия и едкого кали;
хлорид кальция СаС12. Безводная соль применяется для высушивания газов и многих органических жидкостей и как осушительный агент в эксикаторах. При этом образуется кристаллогидрат СuСl2·nН2О (n = 2-6). Насыщенный водный раствор хлорида кальция используют для обогащения сырья флотационным методом;
хлорид бария ВаС12. Применяется как ядохимикат в сельском хозяйстве;
хлорид цинка ZnCl2. Используется при пайке для снятия пленки оксидов (травление металла), а также для пропитки деревянных предметов с целью предохранения их от гниения при закапывании в землю.
Кислородные соединения хлора. Хлор образует четыре кислородсодержащие кислоты: хлорнотистую, хлористую, хлорноватую и хлорную.
Хлорноватистая кислота НСlO образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода:
НСlO = HСl + O
В присутствии водоотнимающих веществ образуется оксид хлора (I):
2 НСlO = 2 Н2О + Сl2O
Cl2О можно считать ангидридом хлорноватистой кислоты. При нагревании хлорноватистая кислота разлагается с образованием двух кислот — соляной и хлорноватой:
3 НСlO = 2 НСl + НСlO3
Поэтому при взаимодействии хлора с горячим раствором щелочи образуется соли не соляной и хлорноватистой, а соляной и хлорноватой кислот:
6 NаОН + 3 Сl2 = 5 NаСl + NаСlО3 + 3 Н2О
Соли хлорноватистой кислоты — г и п о х л о р и т ы — очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоду. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода.
Хлорная, или белильная, известь СаОСl2, или СаСl(СlO), образуется при взаимодействии хлора с порошкообразным гидроксидом кальция — пушенкой:
Са(ОН)2 + Сl2 = Cl-O-Ca-Cl + H2O
или
2 Са(ОН)2 + 2 Сl2 = СаСl2 + Са(ОСl)2 + 2 Н2О
Качество хлорной извести определяется содержанием в ней гипохлорита. Она обладает очень сильными окислительными свойствами и может окислять даже соли марганца до перманганат:
5 СаОСl2 + 2 Mn(NО3)2 + 3 Са(ОН)2 = Са(МпO4)2 + 5 СаСl2 + 2 Са(NО3)2 + 3 H2O
Под действием углекислого газа, содержащегося в воздухе, она разлагается с выделением хлора:
СаОСl2 + СО2 = СаСО3 + Сl2
или
СаСl2 + Са(ОСl)2 + 2 СО2 = 2 СаСО3 + 2 Сl2
Хлорная известь применяется как отбеливающее и дезинфицирующее
вещество.
Хлористая кислота НСlO2 образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлоридов щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
НСlO2 + 3 НС1 = Сl2 + 2 Н2О
Хлориты натрия используются для получения диоксида хлора, при обеззараживании воды, а также как отбеливаюший агент.
Хлорноватая кислота НСlO3 образуется при действии на ее соли —
х л о р а т ы — серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель. Может существовать только в разбавленных растворах. При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40 % хлорной кислоты. При более высоком содержании кислоты раствор разлагается со взрывом. Разложение со взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорная кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно:
НСlO3 + 6 НВr = НСl + 3 Вr2 + 3 Н2О
Соли хлорноватой кислоты — хлораты — образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты — довольно сильные окислители:
КСlO3 + 6 НСl = КСl + 3 Сl2 + 3 Н2О
Хлораты применяются для производства взрывчатых веществ, а также получения кислорода в лабораторных условиях и солей хлорной кислоты- п е р х л о р а т о в. При нагревании бертолетовой соли в присутствии диоксида марганца МпО2, играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот:
2 КСlО3 = 2 КСl + 3 O2
4 КСlO3 = КСl + 3 КСlO4
При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту:
КСlO4 + Н2SO4 = КНSO4 + НСlO4
Это самая сильная кислота. Она наиболее устойчива из всех кислород содержащих кислот хлора, однако безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
20) В подгруппу углерода входят углерод, кремний, германий, олово и свинец. Это р-элементы IV группы периодической системы Д.И. Менделеева. Их атомы на внешнем уровне содержат по четыре электрона ns2np2, чем объясняется сходство их химических свойств.
Электронное строение внешних уровней атомов первых двух элементов подгруппы можно представить так
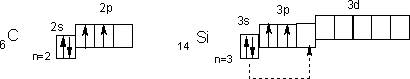
В невозбужденном состоянии их атомы имеют по 2 неспаренных электрона. Поскольку атомы всей подгруппы имеют на внешнем уровне свободные орбитали, то при переходе в возбужденное состояние распаривают электроны s-подуровней (показано пунктирными стрелками).
В соединениях элементы подгруппы углерода проявляют степень окисления +4 и -4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. Степень окисления -4 в последовательности C – Pb становится все менее характерной.
Элементы подгруппы углерода образуют оксиды общей формулы RO2 и RO, а водородные соединения - формулы RН4. Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные - у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RН4: СН4 - прочное вещество, а PbH4 в свободном виде не выделено. В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус, т. е. неметаллические свойства ослабевают, а металлические усиливаются.
21) Углерод (химический символ C) химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса природной смеси изотопов 12,0107 г/моль.
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Структура аллотропных форм углерода: алмаза, графита и карбина.


Алмаз - Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Соседние атомы связаны между собой ковалентными связями (sp3-гибридизация). Такая структура определяет свойства алмаза как самого твердого вещества, известного на Земле.
Графит находит широкое применение в самых разнообразных сферах человеческой деятельности, от изготовления карандашных грифелей до блоков замедления нейтронов в ядерных реакторах. Атомы углерода в кристаллической структуре графита связаны между собой прочными ковалентными связями (sp2- гибридизация) и формируют шестиугольные кольца, образующие, в свою очередь, прочную и стабильную сетку, похожую на пчелиные соты. Сетки располагаются друг над другом слоями. Расстояние между атомами, расположенными в вершинах правильных шестиугольников, равно 0,142 нм., между слоями – 0,335 нм. Слои слабо связаны между собой. Такая структура - прочные слои углерода, слабо связанные между собой, определяет специфические свойства графита: низкую твёрдость и способность легко расслаиваться на мельчайшие чешуйки.
Карбин конденсируется в виде белого углеродного осадка на поверхности при облучении пирографита лазерным пучком света. Кристаллическая форма карбина состоит из параллельно ориентированных цепочек углеродных атомов с sp-гибридизацией валентных электронов в виде прямолинейных макромолекул полиинового (-С= С-С= С-...) или кумуленового (=С=С=С=...) типов.
Известны и другие формы углерода, такие как аморфный углерод, белый углерод (чаоит) и т.д. Но все эти формы являются композитами, то есть смесью малых фрагментов графита и алмаза.
Химические свойства углерода. Графит — типичный восстановитель. При нагревании с избытком воздуха графит (именно этот аллотроп наиболее доступен) образует диоксиды:
С + О2 = СО2,
при недостатке кислорода можно получить монооксиды CO
2С + О2 = 2СО,
которые образуются также при нагревании простых веществ с их диоксидами:
С + СО2 = 2СО,
Уже при обычной температуре углерод реагирует со фтором, образуя тетрафториды СF4, при нагревании — с хлором, давая СCl4. При более сильном нагревании углерод реагирует с серой и азотом:
4С + S8 = 4СS2,
2С + N2 = С2N2,
При взаимодействии с кремнием образует карборунд — вещество, по твердости близкое к алмазу:
Si + С = SiC.
Обычные кислоты на углерод не действуют, тогда как концентрированные Н2SО4 и НNО3 окисляют углерод:
С + 2Н2SО4 = СО2↑+ 2SО2↑ + 2Н2О,
3С + 4НNO3 = 3СО2↑ + 4NO↑ +2Н2О.
Графит часто используют для восстановления малоактивных металлов из их оксидов:
СuО + С = Сu + СО↑.
При нагревании же с оксидами активных металлов углерод диспропорционирует, образуя карбиды
СаО + 3С = СаС2 + СО↑,
2Аl2О3 + 9С = Аl4С3 + 6СО↑
Активные металлы — более сильные восстановители, чем углерод, поэтому последние при непосредственном взаимодействии с ними выступают в качестве окислителей
Са + 2С = СаС2.
22) Оксид углерода является продуктом полного сгорания углерода и содержащих его веществ.
В соединениях с кислородом углерод, в зависимости от условий, проявляет валентности +2 и +4.
При температуре обычного пламени при горении углеродосодержащих веществ (дрова, уголь, природный газ метан, спирт и др.) протекает реакция:
С + О2 = СО2
Если же создать условия для повышения температуры, к примеру, уменьшить теплоотвод (внутри толстого слоя горящего угля, в том числе в доменной печи), то протекают реакции:
С +О2 = 2СО
СО2 + С = 2СО
Так же образуется в случаях:
- окисления биохимических процессов, дыхания, гниения,
- сгорания метана
CH4+O2=CO2+2H2O
- взаимодействия кислот с карбонатами
CaCO3+2HCI=CaCI2+CO2+H2O
- термического разложения карбонатов и гидрокарбонатов:
CaCO3=CaO+CO2
2NaHCO3=Na2CO3+CO2+H2O
Оксид углерода – тяжелее воздуха, это газ без запаха, цвета и вкуса.
1.При растворении взаимодействует с водой, образуя уксусную кислоту:
СО2+Н2О=Н2СО3
2.Реагирует с основными оксидами:
CO2+CaO=CaCO3
3. Реагирует с основаниями:
CO2+Ca(OH)2=CaCO3+H2O
4.2.Угольная кислота.
Слабая двухосновная кислота, которая образуется при растворении оксида углерода СО2 в воде.
Угольная кислота дает два ряда солей:
- водорастворимые гидрокарбонаты (NaHCO 3 – питьевая сода,
Na 2 CO 3 – сода,
K 2 CO3 – поташ),
- нерастворимые (MgCO 3, CaCO 3).
Реакции образования гидрокарбонатов и карбонатов:
CO2+NaOH=NaHCO3
CO2+2NaOH=Na2CO3+H2O
Соли угольной кислоты подвергаются гидролизу.
Угольная кислота вытесняется из солей более сильными кислотами:
CaCO3+2HCI=CaCI2+CO2+H2O
23) В подгруппу кислорода входит пять элементов: кислород, сера, селен, теллур и полоний (радиоактивный металл). Это р-элементы VI группы периодической системы Д.И.Менделеева. Они имеют групповое название – халькогены, что означает «образующие руды».
У атомов халькогенов одинаковое строение внешнего энергетического уровня — ns2nр4. Этим объясняется сходство их химических свойств. Все халькогены в соединениях с водородом и металлами проявляют степень окисления -2, а в соединениях с кислородом и другими активными неметаллами — обычно +4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Он проявляет степень окисления обычно -2 и в соединении со фтором +2. Такие значения степеней окисления следуют из электронного строения халькогенов
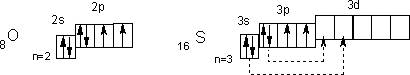
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления -2 и +2 (например, в Н2О и ОF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны (показано стрелками). Число неспаренных электронов, а, следовательно, и валентность в первом случае равны четырем (например, в SO2), а во втором — шести (например, в SO3). Очевидно, четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны -2, +2, +4 и +6.
Водородные соединения элементов подгруппы кислорода отвечают формуле Н2R (R - символ элемента): Н2О, Н2S, Н2Sе, Н2Те. Они называются хальководородами. При растворении их в воде образуются кислоты. Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений Н2R. Вода, диссоциирующая на ионы Н+ и ОН-, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа RО2 и RО3-. Им соответствуют кислоты типа Н2RО3 и Н2RО4-. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа Н2RО3 также и восстановительные.
Закономерно изменяются свойства простых веществ: с увеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства. Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электричество.
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
Кислород может существовать в виде двух аллотропных видоизменений: кислород О2 и озон О3.
При сравнении физических свойств кислорода и озона целесообразно вспомнить, что это газообразные вещества, различающиеся по плотности (озон в 1,5 раза тяжелее кислорода), температурам плавления и кипения. Озон лучше растворяется в воде.
Кислород в нормальных условиях — газ, без цвета и запаха, озон — газ голубого цвета с характерным резким, но приятным запахом.
Есть отличия и в химических свойствах.
Озон химически активнее кислорода. Активность озона объясняется тем, что при его разложении образуется молекула кислорода и атомарный кислород, который активно реагирует с другими веществами. Например, озон легко реагирует с серебром, тогда как кислород не соединяется с ним даже при нагревании
Но в то же время и озон и кислород реагируют с активными металлами, например с калием К.
Химические свойства
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
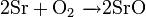
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
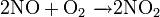
Окисляет большинство органических соединений:

При определенных условиях можно провести мягкое окисление органического соединения:
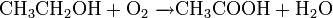
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
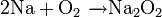
Некоторые оксиды поглощают кислород:

По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
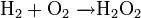
Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода (ион O2 −). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:

Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:

Озониды содержат ион O3 − со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:

Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Кислород поддерживает процессы дыхания, горения, гниения.
Применение
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, декомпрессионной болезни, профилактики гипоксии в виде кислородных коктейлей, кислородных подушек.
В пищевой промышленности
в пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[5], как пропеллент и упаковочный газ.
Биологическая роль кислорода
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
24) Се́ра — элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде.
Химические свойства
1) Сера реагирует со щелочными металлами без нагревания:
2Na + S → Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t°:
2Al + 3S –t°→ Al2S3
Zn + S –t°→ ZnS
2) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S → H2S
2P + 3S → P2S3
C + 2S → CS2
Восстановительные свойства сера проявляет в реакциях с сильными окислителями:
3) c кислородом:
S + O2 →SO2
2S + 3O2 → 2SO3
4) c галогенами (кроме йода):
S + Cl2 → SCl2
5) c кислотами - окислителями:
S + 2H2SO4(конц) → 3SO2 + 2H2O
S + 6HNO3(конц) → H2SO4 + 6NO2 + 2H2O
Реакции диспропорционирования:
6) 3S + 6KOH → K2SO3 + 2K2S + 3H2O
7) сера растворяется в концентрированном растворе сульфита натрия:
S+ Na2SO3 → Na2S2O3 тиосульфат натрия
СЕРОВОДОРОД
Физические свойства
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде; t°пл. = -86°C; t°кип. = -60°С.
Получение
1) H2 + S → H2S
2) FeS + 2HCl → FeCl2 + H2S
Химические свойства
1) Раствор H2S в воде – слабая двухосновная кислота:
H2S «H+ + HS- «2H+ + S2-
K1 = ([H+] • [HS-]) / [H2S] = 1 • 10-7
K2 = ([H+] • [S2-]) / [HS-] = 1,3 • 10-14
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды).
2) Взаимодействует с основаниями:
H2S + 2NaOH → Na2S + 2H2O
3) H2S проявляет очень сильные восстановительные свойства:
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 708; Нарушение авторских прав?; Мы поможем в написании вашей работы!