
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции
|
|
|
|
Основная статья: Скорость химической реакции
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции
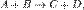 скорость можно выразить так:
скорость можно выразить так:
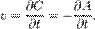
В 1865 году Н. Н. Бекетовым и в 1867 году К. М. Гульдбергом и П. Вааге был сформулирован закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы: природа реагирующих веществ, наличие катализатора, температура (правило Вант-Гоффа) и площадь поверхности раздела фаз.
Молекулярность и порядок реакцииПри изучении реакций выделяют молекулярность и порядок реакции.
Молекулярность реакции - это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения. В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например,запись А > С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В>С или 2А > С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D > С или 2 А + В > С, или 3А>С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее. Выше было сказано, что порядок химической реакции выражаетсяс уммой:
где аi - показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции - экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции bB + dD = P,скорость которой W = КСBbCD d
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принять СB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D, то есть W = К1CD d тогда порядок реакции равен d, а молекулярность реакции (b + d).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина - сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
Ката́лиз (греч. κατάλυσις восходит к καταλύειν — разрушение) — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.[1]
Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.
Явление катализа распространено в природе (большинство процессов, происходящих в живых организмах, являются каталитическими) и широко используется в технике (в нефтепереработке и нефтехимии, в производствесерной кислоты, аммиака, азотной кислоты и др.). Большая часть всех промышленных реакций — это каталитические.
[править]Основные принципы катализа
Катализатор изменяет механизм реакции на энергетически более выгодный, то есть снижает энергию активации. Катализатор образует с молекулой одного из реагентов промежуточное соединение, в котором ослаблены химические связи. Это облегчает его реакцию со вторым реагентом. Важно отметить, что катализаторы ускоряют обратимые реакции, как в прямом, так и в обратном направлениях.
[править]Типы катализа
Катализ может быть положительным (когда скорость реакции увеличивается) и отрицательным (когда скорость реакции уменьшается). Для обозначения отрицательного катализа часто используют термин ингибирование.
Катализ бывает гомогенным и гетерогенным (контактным). В гомогенном катализе катализатор состоит в той же фазе, что и реактивы реакции, в то время, как гетерогенные катализаторы отличаются фазой.
[править] Гомогенный катализ
Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии:
H2О2 + I → H2О + IO
H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
[править] Гетерогенный катализ
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Диффузия реагирующих веществ к поверхности твердого вещества
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
Химическая реакция между реагирующими молекулами
Десорбция продуктов с поверхности катализатора
Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
[править]Носитель катализатора
Металлическая платина (показана стрелками), стабилизированная на носителе — оксиде алюминия
Носитель катализатора, иначе подложка (катализатора) (англ. carrier или support) — инертный или малоактивный материал, служащий для стабилизации на его поверхности частиц активной каталитической фазы.
Роль носителя в гетерогенном катализе состоит в предотвращении агломерации или спекания активного компонента, что позволяет поддерживать высокую площадь контакта активного вещества (см. активная каталитическая фаза) и реагентов. Количество носителя, как правило, гораздо больше количества нанесенного на него активного компонента. Основными требованиями к носителям являются большая площадь поверхности и пористость, термическая стабильность, химическая инертность, высокая механическая прочность. В ряде случаев носитель влияет на свойства активной фазы (эффект «сильного взаимодействия металл–носитель»). В качестве носителей применяют как природные (глины, пемза, диатомит, асбест и др.), так и синтетические материалы (активные угли, силикагель, алюмосиликаты, оксиды алюминия, магния, циркония и др.)[2].
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 804; Нарушение авторских прав?; Мы поможем в написании вашей работы!