
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение Клапейрона-Менделеева
|
|
|
|
Опытные законы идеального газа.
Закон Бойля—Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pv=const при T=const, m=const (1)
Кривая, которая изображает зависимость между величинами р и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс
Законы Гей-Люссака: 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой: V=V0(1+αt)
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p=p0(1+αt)
В этих уравнениях t — температура по шкале Цельсия, p0 и V0 — давление и объем при 0°С, коэффициент α = 1/273,15 К–1.
Процесс, который протекает при постоянном давлении, называется изобарным. На диаграмме в координатах V, t этот процесс изображается прямой, называемой изобарой. Процесс, который протекает при постоянном объеме, называется изохорным. На диаграмме в координатах р, t он изображается прямой, называемой изохорой.
Вводя в формулы термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
V=V0(1+αt)=V0[1+α(T-1/α)]=V0αT,
p=p0(1+αt)=p0[1+α(p-1/α)]=p0αT,
V1/V2 = p1/p2 при p=const, m=const
p1/p2 = T1/T2 при V=const, m=const
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41•10–3 м3/моль.
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро: NA=6,022•1023 моль-1
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1, p2,..., рn входящих в нее газов: p = p1 + p2 +...+ рn
Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: 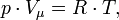
где p — давление, Vμ — молярный объём, T — абсолютная температура, R — универсальная газовая постоянная.
Так как 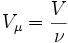 , где где ν — количество вещества, а
, где где ν — количество вещества, а 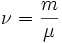 , где m — масса, μ — молярная масса, уравнение состояния можно записать:
, где m — масса, μ — молярная масса, уравнение состояния можно записать:
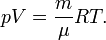 Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение можно записать в виде: 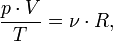
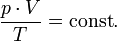
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
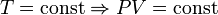 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
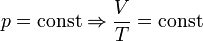 — закон Гей-Люссака.
— закон Гей-Люссака.
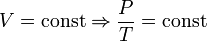 — закон Шарля
— закон Шарля
30. Основное уравнение молекулярно-кинетической теории идеальных газов.

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1256; Нарушение авторских прав?; Мы поможем в написании вашей работы!