
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Паули и емкость электронных оболочек. Правило Хунда. Порядок заполнения атомных орбиталей. Правила Клечковского. Строение электронных оболочек атомов химических элементов
|
|
|
|
Квантовые числа как характеристика состояния электрона в атоме. Физический смысл квантовых чисел. Энергетический уровень, подуровень. Атомная орбиталь. Форма и ориентация электронных облаков.
Для характеристики орбиталей и электронов используются квантовые числа.
Главное квантовое число (n) определяет общую энергию электрона на данном уровне, или средний радиус электронного облака. Оно принимает натуральные значения от 1 до ∞ (до бесконечности). В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K, L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона). Теоретически количество уровней не ограничено, но в атоме главным образом бывают заняты электронами уровни с низкой энергией.
Побочное (орбитальное) квантовое число (ℓ) – характеризует форму орбиталей и облаков, используется для характеристики энергетических подуровней. Оно может принимать в пределах каждого уровня целочисленные значения от 0 до n–1. Таким образом, уровень в зависимости от ℓ подразделяется на подуровни, которые имеют также буквенные обозначения: s (ℓ = 0) орбиталь имеет форму шара, p (ℓ = 1) орбиталь имеет форму гантели, d (ℓ = 2), f (ℓ = 3). Электроны, находящиеся в этих состояниях, называются s-, p-, d- и f-электронами.
Изменение значения волновой функции электронов, находящихся на 1s- 3ss ние значения волновой функции электронов, находящихся на, 2s-, 3s-, 2p-, 3p-, 3d-подуровнях в зависимости от расстояния (R) от ядра атома: Только значение волновой функции s-электронов отлично от нуля в начале координат (ядро атома), причем, она (а значит и ее 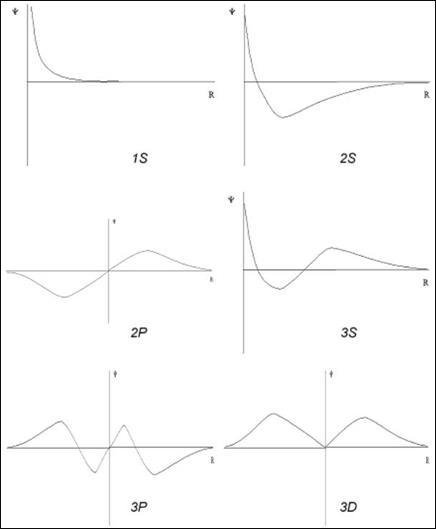 квадрат) обладает сферической симметрией. Волновые функции имеют узлы волновой функции – это точки пересечения кривой оси абсцисс, в которых значение волновая функции равно нулю. Количество узлов определяется значениeмm главного и орбитального квантовыx чисел. Так, 1s – функция не имеет узлов, 2s – один узел, 3s - два узла, и т.д. 2р – имеет узел в начале координат, 3р – два узла, и т.д.ddddd s ферической симметриейs-облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции
квадрат) обладает сферической симметрией. Волновые функции имеют узлы волновой функции – это точки пересечения кривой оси абсцисс, в которых значение волновая функции равно нулю. Количество узлов определяется значениeмm главного и орбитального квантовыx чисел. Так, 1s – функция не имеет узлов, 2s – один узел, 3s - два узла, и т.д. 2р – имеет узел в начале координат, 3р – два узла, и т.д.ddddd s ферической симметриейs-облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции 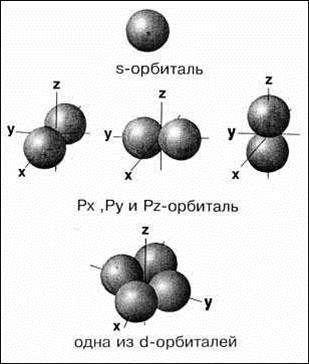 Y расположен по одну сторону от оси абсцисс, т.е. волновая функция 1s-электрона положительна. Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб. По одну сторону от ядра Y положительна, а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В начале координат Y обращается в нуль. В отличие от s-орбитали, p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель.
Y расположен по одну сторону от оси абсцисс, т.е. волновая функция 1s-электрона положительна. Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб. По одну сторону от ядра Y положительна, а по другую – отрицательна (не путать знак волновой функции со знаком электрического заряда!). В начале координат Y обращается в нуль. В отличие от s-орбитали, p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель.
Знаки “+” и “–” относятся не к вероятности нахождения электрона (она всегда положительна и равна |Y|2), а к волновой функции, которая в разных частях электронного облака имеет различный знак. Еще более сложную форму имеют электронные облака d- и f-электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются.
Магнитное квантовое число (ml) – характеризует направление орбиталей (электронных облаков в пространстве). Магнитное квантовое число mℓ для данного подуровня – это целочисленная величина в диапазоне от –l до +l. Таким образом, при данном ℓ оно имеет (2ℓ+1) различных значений. Например, для s-подуровня (ℓ = 0) имеется только одно значение mℓ, равное нулю. Поэтому s-подуровень содержит единственную орбиталь. Для p-подуровня (ℓ = 1) возможны три значения: mℓ{–1,0,1}. В соответствии с этим каждый p-подуровень состоит из трех орбиталей гантелеобразной формы, ориентированных перпендикулярно друг другу вдоль трех координатных осей и обозначаемых px, py, pz. Легко определить, что на d-подуровне (ℓ = 2) содержится 2ℓ+1=5 орбиталей, а на f-подуровне (ℓ = 3) – 7 орбиталей. Графически любая орбиталь изображается в виде клетки (квантовой ячейки – атомная орбиталь).
Спиновое квантовое число (ms) не связано с движением электрона вокруг ядра, а определяет его собственное состояние- характеризует вращение электрона вокруг своей оси и принимает два значения: +1/2 (стрелка вверх) и –1/2 (стрелка вниз).
Энергетический уровень – это совокупность орбиталей, которые имеют одинаковое значение главного квантового числа.
Энергетический подуровень – это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму.
ЭУ электронный уровень, ЭПУ – электронный подуровень, АО – атомная орбиталь (квантовая ячейка), которую принято изображать клеткой. Электроны на орбиталях изображены стрелками ↑↓, направленными вверх или вниз в зависимости от знака спинового квантового числа. Изображение электронной структуры атома или иона с помощью клеток и стрелок называется электронно-графической формулой.
Распределение электронов в многоэлектронном атоме основано на принципе минимума энергии, принципе В.Паули, правиле Ф.Хунда и правиле Клечковского.
Принцип минимума энергии: Электрон в первую очередь располагается в пределах электронной подоболочки с наинизшей энергией. Вначале заполняются орбитали, характеризующиеся наименьшей потенциальной энергией.
Принцип Паули: В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Следовательно, каждая орбиталь, характеризующаяся определенными значениями n, ℓ и mℓ, может быть занята не более чем двумя электронами, спины которых имеют противоположные знаки. Такие электроны называются спаренными. Пользуясь принципом Паули, можно подсчитать, какое максимальное число электронов может находиться на каждом уровне и подуровне, т.е. определить емкость уровней и подуровней. Количество орбиталей на подуровне определяется количеством возможных значений магнитного квантового числа, т.е. 2ℓ + 1 значение. Так как на каждой орбитали (определенное значение квантовых чисел n, ℓ и mℓ) может разместиться два электрона, обладающие разными значениями спина, то максимальное количество электронов, которое можно разместить на данном подуровне равно: 2(2ℓ + 1). Максимальное количество электронов, которое может находиться на данном уровне, характеризующемся главным квантовым числом n, равно 2n2.
Правило Хунда: В наиболее устойчивом состоянии атома электроны размещаются в пределах электронной подоболочки так, чтобы их суммарный спин был максимален. м являеисясостояниеки наиболлеронов, которое может находиться на данном уровне, характеризующимся главным квантовым числом
Так, например, у атома азота на внешнем электронном уровне находится два и три р-электрона. Здесь электроны на орбиталях изображены стрелками, направленными вверх или вниз в зависимости от знака спинового квантового числа. s-Подуровень содержит единственную орбиталь, на которой находится два электрона с противоположными спинами в соответствии с принципом Паули. В соответствии с правилом Хунда минимум энергии будет обладать конфигурация, в которой на каждой из трех р-орбиталей будет находиться по одному электрону с одинаково направленными спинами, поэтому суммарный спин будет максимальным (±3/2):
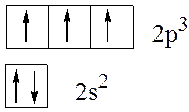
Первое правило Клечковского: Электрон обладает наинизшей энергией на той электронной подоболочке, где сумма главного и орбитального квантового числа минимальна. Е = min при n + ℓ = min. В соответствии с первым правилом Клечковского заполнение подуровней электронами происходит в порядке от подуровней с минимальным значением суммы (n + ℓ) к подуровням большими значениями n + ℓ. Если сумма (n + ℓ) одинакова для рассматриваемых электронных подоболочек, при распределении электронов используется второе правило Клечковского: Электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 6334; Нарушение авторских прав?; Мы поможем в написании вашей работы!