
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь. Основные положения метода валентных связей. Спиновая теория валентности. Обменный и донорно-акцепторный механизм образования ковалентной связи
|
|
|
|
Образование ковалентной связи можно рассматривать в рамках двух методов квантовой химии: метода валентных связей и метода молекулярных орбиталей.
В 1916 г. американский ученый Льюис высказал предположение о том, что химическая связь образуется за счет обобществления двух электронов. При этом электронная оболочка атома стремится по строению к электронной оболочке благородного газа. В дальнейшем эти предположения послужили основой для развития метода валентных связей. Образование химической связи между атомами водорода является результатом взаимопроникновения (перекрывания) электронных облаков. Вследствие этого перекрывания плотность отрицательного заряда в межъядерном пространстве возрастает, и положительно заряженные ядра притягиваются к этой области. Такая химическая связь называется ковалентной.
Представления о механизме образования молекулы водорода были распространены на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам и находится на орбитали, образовавшейся за счет перекрывания двух атомных орбиталей.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные
облака. Связь образуется в том случае, когда в атомные волновые функции образующие связь будут иметь одинаковые знаки в области перекрывания.
3) Химическая связь в методе ВС является двухцентровой и локализована в области между ядрами двух атомов ее образующих.
Метод валентных связей (ВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. B образовании химической связи принимают участие валентные электроны.
Валентность атома в данном соединении – это количество общих электронных пар, которые данный атом образует с другими атомами. Например, валентность азота в аммиаке (NH3) равна трем, а в ионе аммония (NH4+) – четырем.
Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Способы образования ковалентной связи: Существуют два главных способа образования ковалентной связи.
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень и в атоме углерода появлется вместо двух (основное состояние) четыре неспаренных электрона: С 1s22s22p2 → C* 1s22s12p3
Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p6 3s13p33d1 (валентность 5)
S* 1s22s22p6 3s13p33d2 (валентность 6)
Cl* 1s22s22p6 3s13p33d3 (валентность 7)
В приведенных выше электронных формулах возбужденных атомов подчеркнуты подуровни, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
Cl 1s22s22p63s2 3p5 (валентность 1) → Cl* 1s22s22p63s2 3p43d1 (валентность 3) →
Cl* 1s22s22p63s2 3p33d2 (валентность 5) → Cl*1s22s22p6 3s13p33d3 (валентность 7)
В отличие от хлора, валентность атома F постоянна и равна 1, т.к. на валентном (втором) энергетическом уровне отсутствуют орбитали d-подуровня и другие вакантные орбитали.
Различают два механизма образования ковалентной связи – обменный и донорно-акцепторный.
Обменный возникает посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону в обобществленную электронную пару. Это наиболее типичный механизм образования ковалентной связи (например в молекулах: HBr, HCl, H2, N2, и.т.д.).
Донорно-акцепторный механизм заключается в том, что ковалентная связь образуется в результате перехода уже существующей электронной пары донора (поставщика электронов) в общее пользование донора и акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония: NH3 + H+ = NH4+
В молекуле аммиака три ковалентные связи образованы по обменному механизму, так как у атома азота имелись три неспаренных электрона, а у атомов водорода по одному. В тоже время у атома азота на внешнем энергетическом уровне было пять электронов и после образования молекулы аммиака осталась одна неподеленная пара электронов. В катионе водорода (протоне) отсутствует электронная оболочка, а значит остается свободной орбиталь. Таким образом, атом азота в аммиаке является донором электронной пары, а протон – ее акцептором при образовании иона аммония.
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н—N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. все связи равноценны, независимо от механизма их образования. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s- и 2р-электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали (здесь осуществляется sp3-гибридизация).
В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н+ в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н2О и иона Н+ всегда образуется ион гидро-ксония Н3О+ Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H+.
Донорно-акцепторный механизм образования связи помогает понять причину амфотерности гидроксида алюминия в молекулах Аl(ОН)3 вокруг атома алюминия имеется 6 электронов — незаполненная электронная оболочка. Для завершения этой оболочки не хватает двух электронов. И когда к гидроксиду алюминия прибавляют раствор щелочи, содержащей большое количество гидроксильных ионов, каждый из которых имеет отрицательный заряд и три неподеленные пары электронов (ОН)-, то ионы гидроксида атакуют атом алюминия и образуют ион [Аl(ОН)4]-, который имеет отрицательный заряд (переданный ему гидроксид-ионом) и полностью завершенную восьмиэлектронную оболочку вокруг атома алюминия.
Аналогично происходит образование связей и во многих других молекулах, даже в таких “простых”, как молекула НNО3:
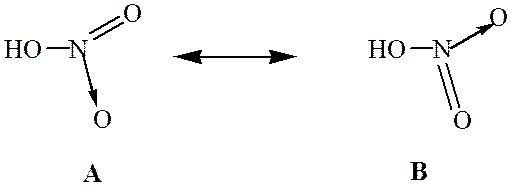
Атом азота при этом отдает свою электронную пару атому кислорода, который ее принимает: в результате как вокруг атома кислорода, так и вокруг азота достигается полностью завершенная восьмиэлектронная оболочка, но поскольку атом азота отдал свою пару и поэтому владеет ею совместно с другим атомом, он приобрел заряд “+”, а атом кислорода — заряд “-”. Cтепень окисления азота в HNO3 равна 5+, тогда как валентность равна 4.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2218; Нарушение авторских прав?; Мы поможем в написании вашей работы!