
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изобарический и изохорические процессы, теплоемкость в таких процессах
|
|
|
|
Изобарный процесс - термодинамический процесс, происходящий в системе при постоянном давлении и массе идеального газа. Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе  .
.
Работа, совершаемая газом при расширении или сжатии газа, равна A = P Δ V.
Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δ Q = Δ I = Δ U + P Δ V.
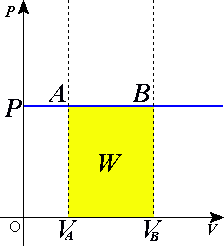 График изобарического расширения газа от объёма Va до Vb. AB здесь является изобарой.
График изобарического расширения газа от объёма Va до Vb. AB здесь является изобарой.
Молярная теплоёмкость при постоянном давлении обозначается как Cp. В идеальном газе она связана с теплоёмкостью при постоянном объёме соотношением Майера Cp = Cv + R.
Молекулярно-кинетическая теория позволяет вычислить приблизительные значения молярной теплоёмкости для различных газов через значение универсальной газовой постоянной: для одноатомных газов  , то есть около 20.8 Дж/(моль·К); для двухатомных газов
, то есть около 20.8 Дж/(моль·К); для двухатомных газов 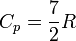 , то есть около 29.1 Дж/(моль·К); для многоатомных газов Cp = 4 R, то есть около 33.3 Дж/(моль·К).
, то есть около 29.1 Дж/(моль·К); для многоатомных газов Cp = 4 R, то есть около 33.3 Дж/(моль·К).
Изохорический или изохорный процесс -это термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
Теплоемкость

|
17.Изотермический и адиабатический процессы: реализация, работа и уравнения
Изотермический процесс — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Для осуществления изотермического процесса систему обычно помещают в термостат, теплопроводность которого велика, так что теплообмен с системой происходит достаточно быстро по сравнению со скоростью протекания процесса, и, температура системы в любой момент практически не отличается от температуры термостата. Графиком изотермического процесса является изотерма.
В идеальном газе при изотермическом процессе произведение давления на объём постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах p, V — гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс.
При изотермическом процессе системе, вообще говоря, сообщается определённое количество теплоты (или она отдаёт теплоту) и совершается внешняя работа. Альтернативный процесс, при котором теплообмен с окружающей средой отсутствует (термодинамическая система находится в энергетическом равновесии — система не поглощает и не выделяет тепло), называется адиабатическим процессом.
Работа, совершенная идеальным газом в изотермическом процессе, равна 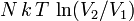 , где
, где 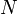 — число частиц газа,
— число частиц газа, 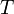 — температура,
— температура, 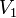 и
и  — объём газа в начале и конце процесса,
— объём газа в начале и конце процесса, 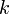 — постоянная Больцмана.
— постоянная Больцмана.
В твёрдом теле и большинстве жидкостей изотермические процессы очень мало изменяют объём тела, если только не происходит фазовый переход.
Первый закон термодинамики для изотермического процесса в идеальном газе записывается в виде: 
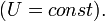

Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии. В общем случае адиабатический процесс необратим.
Линия, изображающая адиабатный процесс на какой-либо термодинамической диаграмме, называется адиабатой.

Для адиабатического процесса первое начало термодинамики в силу отсутствия теплообмена (Δ Q = 0) системы со средой имеет вид  , где:
, где:  — изменение внутренней энергии тела,
— изменение внутренней энергии тела, 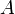 — работа, совершаемая системой,
— работа, совершаемая системой, 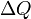 — теплота, полученная системой
— теплота, полученная системой
Основное уравнение термодинамики применительно к адиабатическому процессу записывается в дифференциалах как  ,
,
где  — дифференциальное выражение для работы, ai — внешние параметры, Ai — соответствующие им внутренние параметры. В частном случае, когда работа совершается через изменение объёма,
— дифференциальное выражение для работы, ai — внешние параметры, Ai — соответствующие им внутренние параметры. В частном случае, когда работа совершается через изменение объёма,  , где p — давление.
, где p — давление.
Для идеальных газов адиабата имеет простейший вид и определяется уравнением:  , где:
, где: 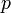 — давление газа,
— давление газа, 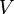 — его объём,
— его объём, 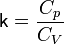 — показатель адиабаты,
— показатель адиабаты, 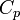 и
и  — теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
— теплоёмкости газа соответственно при постоянном давлении и постоянном объёме.
Показатель адиабаты: Для нерелятивистского невырожденного одноатомного идеального газа  , для двухатомного
, для двухатомного 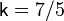 , для трёхатомного
, для трёхатомного 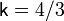 , для газов состоящих из более сложных молекул, показатель адиабаты,
, для газов состоящих из более сложных молекул, показатель адиабаты, 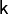 определяется числом степеней свободы конкретной молекулы.
определяется числом степеней свободы конкретной молекулы.
При адиабатическом процессе показатель адиабаты равен 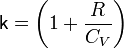 , где R — универсальная газовая постоянная.
, где R — универсальная газовая постоянная.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду:
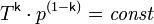 , где T — абсолютная температура газа.
, где T — абсолютная температура газа.
Или к виду:

Поскольку 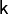 всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (т.е. при уменьшении V) газ нагревается (T возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов.
всегда больше 1, из последнего уравнения следует, что при адиабатическом сжатии (т.е. при уменьшении V) газ нагревается (T возрастает), а при расширении — охлаждается, что всегда верно и для реальных газов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2332; Нарушение авторских прав?; Мы поможем в написании вашей работы!