
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Sp3-гибридизация
|
|
|
|
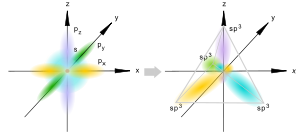

sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра, тогда как ядро центрального атома расположено в центре описанной сферы этого тетраэдра. Угол между любыми двумя осями приближённо равен 109°28'[3], что соответствует наименьшей энергии отталкивания электронов. Также sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.Такое состояние характерно для атомов углерода в насыщенных углеводородах и соответственно в алкильных радикалах и их производных.
63.Мономолекулярное нуклеофильное замещение.
Мономолекулярное нуклеофильное замещение проходит через стадию образования карбониевого иона. Он имеет плоскую пространственную структуру и может быть атакован заместителем Z равновероятно с обеих сторон. Мономолекулярное нуклеофильное замещение (SN1) - реакция нуклеофильного замещения у алифатического атома углерода, в скоростьлимитирующей стадии которой субстрат ионизируется с отщеплением уходящей группы и образованием карбкатиона. Протекает как двухстадийный процесс. Результат мономолекулярного нуклеофильного замещения в стереохимическом смысле может быть различным. При мономолекулярном нуклеофильном замещении только молекула субстрата изменяет состояние своих связей во время стадии, определяющей скорость реакции. Оттягивание электронов электрофильной группой X вызывает диссоциацию молекулы RX на (сольватированные) ионы, чему способствуют растворитель и в некоторых случаях катализаторы. Эти ионы затем реагируют с другим веществом, участвующим в реакции, давая конечный продукт. При мономолекулярном нуклеофильном замещении только молекула субстрата изменяет состояние своих связей во время стадии, определяющей скорость реакции. Оттягивание электронов электрофильной группой X вызывает диссоциацию молекулы RX на (сольватированные) ионы, чему способствуют растворитель и в некоторых случаях катализаторы. Эти ионы затем реагируют с другим веществом, участвующим в реакции, давая конеч-лый продукт. [ 5 ]
При мономолекулярном нуклеофильном замещении разрыв связи R-X и образование связи R-Y происходят не одновременно. Реакция, таким образом, приводит к образованию определенного и в принципе доказуемого промежуточного продукта (промежуточная стадия), представляющего собой более или менее сольватированный ион карбония (см. стр. [ 6 ]
В реакциях мономолекулярного нуклеофильного замещения разрыв старой и образование новой связи происходит в разное время, поэтому их называют асинхронными. [ 7 ]
Пространственная направленность мономолекулярного нуклеофильного замещения менее однозначна. [ 8 ]
По механизму мономолекулярного нуклеофильного замещения (Sjvl) идут реакции замещения диазогруппы на гидроксильную группу, алкоксильную группу, фтор. [ 9 ]
Стереохимический результат мономолекулярного нуклеофильного замещения может быть различным. [ 10 ]
Выражение 5N1 означает мономолекулярное нуклеофильное замещение. [ 11 ]
Напротив, при мономолекулярном нуклеофильном замещении в качестве промежуточного продукта образуется карбониевый ион, который благодаря своей высокой реакционной способности одинаково хорошо может реагировать с менее или более реакционноспособным веществом.
64.Окисление азотсодержащих соединений.
65.Производные моносахаридов. Дезоксисахара.
Моносахариды – это полигидроксикарбонильные соединения, в которых каждый атом углерода (кроме карбонильного) связан с группой ОН. Общая формула моносахаридов – Сn(H2O)n, где n =3-9.
По химическому строению различают:
- альдозы – моносахариды, содержащие альдегидную группу;
- кетозы – моносахариды, содержащие кетонную группу (как правило, в положении 2).
В зависимости от длины углеродной цепи моносахариды делятся на триозы, тетрозы, пентозы, гексозы и т.д. Обычно моносахариды классифицируют с учетом сразу двух этих признаков, например:
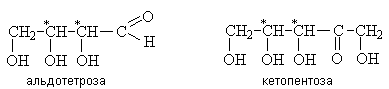
В природе встречаются производные моносахаридов, содержащие аминогруппу (аминосахара), карбоксильную группу (сиаловые кислоты, аскорбиновая кислота), а также атом Н вместо одной или нескольких групп ОН (дезоксисахара.
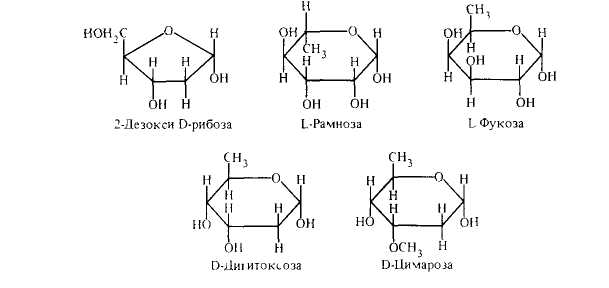
ДЕЗОКСИСАХАРА — моносахариды, в которых одна или несколько гидроксильных групп замещены атомами водорода; в соответствии с этим различают монодезокси-, дидезокси-тридезоксисахара и т. д.
Дезоксисахара редко встречаются в свободном виде и обычно являются компонентами гликозидов, олиго- и полисахаридов.
Важнейший представитель 2-дез-оксисахаров — 2-дезокси-D-рибоза, входящая в состав дезоксирибонуклеиновых кислот (ДНК). Чрезвычайно распространен класс 6-дезоксиальдогексоз: L-рамноза, L-фруктоза — компоненты полисахаридов, кардиотонических гликозидов. В последнее время соединения этой группы обнаружены и в некоторых антибиотиках. Представители 2,6-дидезоксиальдо-гексоз и их 3 — O-метиловые эфиры входят в состав сахаристой остатка кардиотонических гликозидов, например D-дигитоксоза, D-цимроза.
66.Окисление серосодержащих соединений.
Сера в первую очередь необходима для синтеза и регуляции количества и качества производимого растениями белка, так как входит в состав двух серосодержащих аминокислот: цистеина и метионина, различающихся по положению серы в молекуле.

Цистеин — главный продукт ассимиляторного восстановления серы и ключевой компонент биосинтеза белка, глутатиона и фитохелатинов. SH-группы цистеиновых остатков участвуют в образовании ковалентных, водородных, меркаптидных связей, поддерживающих трехмерную структуру белковой молекулы. Свободные тиоловые группы определяют каталитическую активность многих ферментов, например взаимодействие белка с коферментом. Четыре SH-группы, хелатируя атом железа, формируют железосерные центры в белках— компонентах электрон-транспортных цепей энергопреобразующих мембран.
Метиониновые остатки придают молекуле белка гидрофобные свойства, что важно при стабилизации активной конформации белковой молекулы. S-аденозилметионин участвует в реакциях трансметилирования. Метионил-тРНК выступает инициатором роста полипептидных цепей. Донором S для биосинтеза метионина является цистеин.
Из наиболее функционально важных серосодержащих органических молекул следует назвать ацетилкоэнзим А (ацетил - СоА), липоевую кислоту, биотин, тиаминпирофосфат (витамин В1).
SH-группа коэнзима А образует высокоэнергетическую тиоэфирную связь с ацильными группами кислот. В частности, ацетил-СоА служит переносчиком ацетильной группы в реакциях биосинтеза жирных кислот, углеводов и аминокислот. Ряд вторичных соединений образуется из цистеина при замещении и окислении сульфгидрильной группы, например аллиины и α-аминоакриловая кислота. Серу содержат многие растительные масла, в том числе горчичное и чесночное. У растений серосодержащие вторичные метаболиты широко представлены в семействах Liliaceae, Brassiaceae, Mimosaceae.
67.Производные моносахаридов. Аскорбиновая кислота.
аскорби́новая кислота́ — органическое соединение, родственное глюкозе, является одним из основных веществ в человеческом рационе, которое необходимо для нормального функционирования соединительной и костной ткани. Выполняет биологические функции восстановителя и кофермента некоторых метаболических процессов, является антиоксидантом. Биологически активен только один из изомеров — L- аскорбиновая кислота, который называют витамином C. В природе аскорбиновая кислота содержится во многих фруктах и овощах[3]. Авитаминоз аскорбиновой кислоты приводит к цинге. Свойства
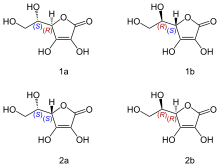

Оптические изомеры аскорбиновой кислоты:
1a — L- аскорбиновая кислота,
2a — L- изоаскорбиновая кислота,
1b — D- изоаскорбиновая кислота,
2b — D- аскорбиновая кислота
По физическим свойствам аскорбиновая кислота представляет собой белый кристаллический порошок кислого вкуса. Легко растворим в воде, растворим в спирте.[2]
Из-за наличия двух асимметрических атомов существуют четыре диастереомера аскорбиновой кислоты. Две условно именуемые L- и D- формы хиральны относительно атома углерода в фурановом кольце, а изо- форма является D- изомером по атому углерода в боковой этиловой цепи.
L- изоаскорбиновая, или эриторбовая, кислота используется в качестве пищевой добавки E315.
68.Системы с замкнутой цепью сопряжении. Смотреть 49 вопрос.
69.α-Аминокислоты, медико – биологическое значение.
Аминокислоты - полифункциональные соединения, содержащие амино - (-NН2) и карбоксильную (-СООН) группы, которые присоединены к альфа-углероду, между собой аминокислоты реагируют с образованием пептидной связи.
Аминокислоты, которые не могут синтезироваться в организме и должны поступать с пищей, называются незаменимыми, а синтезируемые в организме - заменимыми. Отсутствие хотя бы одной аминокислоты вызывает отрицательный азотистый баланс, нарушение деятельности ЦНС, остановку роста и тяжелые клинические последствия за счет нарушения синтеза физиологически значимых белков.
Биологическая полноценность белков определяется расчетом аминокислотного скора, который выражается в процентах или безразмерной величиной, представляющей собой отношение содержания незаменимой аминокислоты в исследуемом объекте к ее количеству в эталонном белке:
А. С. = (мг АК в 1 г белка\ мг АК в 1 г этал. белка) х 100%.
Аминокислота, скор которой имеет самое низкое значение в белке, называется первой лимитирующей аминокислотой.
Все аминокислоты-амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы — COOH, так и основные свойства, обусловленные аминогруппой — NH 2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH 2 — CH 2 — COOH + HCl → HCl • NH 2 — CH 2 — COOH (хлороводородная соль глицина)
NH 2 — CH 2 — COOH + NaOH → H 2 O + NH 2 — CH 2 — COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
NH 2 — CH 2 COOH  N + H 3 — CH 2 COO -
N + H 3 — CH 2 COO -
Получение
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
CH 3 COOH + Cl 2 + (катализатор) → CH 2 ClCOOH + HCl; CH 2 ClCOOH + 2NH 3 → NH 2 — CH 2 COOH + NH 4 Cl
70. Приведите структурные формулы и названия трех углеводородов, содержащих атомы углерода в различных валентных состояниях.
71.Сколько третичных углеродных атомов в молекуле изобутана?
Молекула изобутана свидетельствует о том, что появился третичный атом углерода у группы СН за счет уменьшения числа вторичных. [ 1 ]
В молекуле изобутана мы вновь встречаемся с двоякого рода водородными атомами: девять из них входят в состав совершенно одинаково расположенных групп СН3 и отличаются по своему положению от десятого водородного атома. [ 2 ]
В молекуле изобутана мы вновь встречаемся с двоякого рода водородными атомами: девять из них входят в состав совершенно одинаково расположенных групп СНд и отличаются по своему положению от десятого водородного атома. [ 3 ]
В молекуле изобутана углеродные атомы в являются первичными, а атом г - третичным углеродным атомом, так как на соединение с другими углеродными атомами затрачены три его валентные связи. Все первичные углеродные атомы равноценны между собой, поскольку они соединены с одним и тем же третичным углеродом. [ 4 ]
При отщеплении от молекулы изобутана молекулы водорода образуется молекула изобутилена. [ 5 ]
Изооктил-ион реагирует с молекулой изобутана, образуя 2 2 4-триметилпентан и карбоний-ион, который продолжает реакцию. [ 6 ]
Каждый карбоний-ион выше С8 способен реагировать с молекулой изобутана; образуется С8 - изопарафин и третичный бутил-ион, который, в свою очередь, стремится прореагировать с еще одной молекулой 2-бутена, образуя реакционную цепочку. Несмотря на то, что приложение этого механизма реакции к 1-бу-тену показывает, что должны образовываться другие изопарафины, на практике найдено, что и 1 - и 2-бутены в присутствии серной и фтористоводородной кислот дают одни и те же продукты. Объяснить это можно только предположив, что 1-бутен изоме-ризуется в 2-бутен и что оба олефина образуют одинаковый карбоний-ион. [ 7 ]
Молекулы пропана входят в поры шабазита и адсорбируются, а молекулы изобутана вследствие разветвленного строения войти в эти поры не могут. [ 8 ]
Однако температура не является фактором, однозначно характеризующим силу дисперсионного взаимодействия молекул изобутана и нефтепродукта, так как не учитывает давление в системе. В этом случае более емким показателем является удельный объем изобутана - величина, учитывающая я давление. Поэтому полученные кривые (см. рис. 2) могут быть аппро-сишфованы, если на оси абсцисс отлепить удельный объем изобутана при данной температуре и давлении, равном упругости его паров. [ 9 ]
При высокой концентрации изобутана в реакционной зоне создаются благоприятные условия для отрыва гидрид-иона от молекулы изобутана, а не от изопарафинов алкилата. Даже при использовании пропиленобого сырья высокое соотношение изобутана и олефина способствует максимальному образованию углеводородов С8, имеющих наивысшее октановое число, и улучшает выход алкилата. [ 10 ]
Образование диметилгексанов происходит главным образом за счет содимеризации бутена-1 и изобутилена и последующего отрыва гидрид-иона от молекулы изобутана. Этот механизм значительно отличается от ранее принятого. Высокая исходная концентрация бутена-1, таким образом, способствует образованию диметилгексанов. Возможна частичная изомеризация диметилгексил-карбоний-иона. [ 11 ]
Образование насыщенных тяжелых углеводородов, по-видимому, объясняется полимеризацией олефинов, за которой следует отрыв гидрид-иона от молекулы изобутана. Наличие бутена-1 и пропилена, низкое содержание воды в катализаторе, невысокое соотношение изобутана и олефина - вот факторы, способствующие образованию тяжелых углеводородов. [ 12 ]
72.Сколько вторичных углеродных атомов в молекуле н-бутана?
Молекула бутана содержит прохиральный атом углерода. Прохи-рвльиым называется атом углерода, который может стать хиральным при замещении одного из двух идентичных атомов (водорода или других групп) на ахиральный заместитель. Такие атомы называются эиаитио-тоаиыми. Молекула, в которой имеется прохиральный атом углерода, прохиральиой. Молекула бутана может рассматриваться как производное этана, в котором два атома водорода замещены двумя метальными группами. Поскольку эти группы более объемисты, чем водородные атомы, в молек Молекула бутана может рассматриваться как производное этана, в котором два атома водорода замещены двумя метильными группами. Поскольку эти группы более объемисты, чем водородные атомы, в молекуле бутана появляются более сильные силы отталкивания для заслоненной конформаций. [ 3 ]
Молекула бутана содержит прохиральный атом углерода. Прохиральным называют атом углерода, который становится хиральным при замещении одного из двух идентичных атомов (водорода или других групп) на ахиральный заместитель. Молекула, в которой
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 3408; Нарушение авторских прав?; Мы поможем в написании вашей работы!