
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок заполнения орбитали
|
|
|
|
Квантовые числа
Волновая функция
понятие волновой функции - характеристики состояний химических систем, зависящей от координат частиц и являющейся решением уравнения Шрёдингера. Это уравнение связывает волновые функции с возможными значениями энергии состояний при заданном числе электронов и ядер и известном взаимном расположении последних. Зная волновые функции, можно определить распределение электронного заряда, рассчитать моменты молекулы, вычислить ее спектроскопические и резонансные характеристики, описать ее реакционную способность, рассчитать зонную структуру кристалла и т.д.
Для простых систем волновые функции рассчитывают численно, для систем более сложных и представляющих практический интерес для химиков это невозможно. Поэтому при расчетах приходится вводить различные приближения. Одним из основных приближений, используемом в большинстве квантовохимических расчетов, является приближение Борна-Оппенгеймера. Оно основано на идее раздельного рассмотрения волновых функций, описывающих состояния электронов и ядер. Более тяжелые ядра двигаются намного медленней электронов и при описании многих электронных процессов могут считаться неподвижными. В результате математическая задача определения электронных волновых функций сильно упрощается. Теория химической связи, например, построена именно в этом приближении.
главное квантовое число,латинская буква n, показывает номер энергетического уровня, равно от 1 до бесконечности (на сегодняшний день максимальное значение 7, точно не скажу);
орбитальное квантовое число, латинская буква l, указывает на подуровень на уровне и форму орбитали, принимает значения от 0 до (n-1),на сегодня известны s(при l=0),p,d,f,g-орбитали;
Магнитное квантовое число, латинская буква m, значения целые от -l,..,0,...l,
Спиновое квантовое число, буква s, +1/2 или -1/2
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталейв многоэлектронных атомах.
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением . При одинаковой сумме раньше заполняется орбиталь с меньшим значением 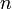 . .
|
http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B0%D0%B2%D0%B8%D0%BB%D0%BE_%D0%9A%D0%BB%D0%B5%D1%87%D0%BA%D0%BE%D0%B2%D1%81%D0%BA%D0%BE%D0%B3%D0%BE
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!