
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь. Виды химической связи
|
|
|
|
Виды химической связи
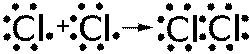
Теория ковалентной связи, основанная Г.Н.Льюисом в 1916 году, заключалась в том, что химическая связь возникает в результате образования общей электронной пары между взаимодействующими атомами.
Характеризуется увеличение электронной плотности между ядрами связанных атомов. Каждый атом предоставляет один или несколько электронов для образования химической связи. Происходит образование общих электронных пар, достраивающих электронные уровни обоих атомов. В зависимости от того, сколько электронов способен предоставить каждый атом происходит образование одной (одинарная) или нескольких (кратная) электронных пар. В результате на прямой, соединяющей два атомных ядра происходит увеличение электронной плотности, к которой притягиваются атомные ядра. Идеальная ковалентная связь характерна только для двух одинаковых атомов. Например 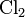 ,
, 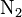 . В случае
. В случае 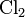 , каждый из атомов хлора, имеющих на внешней электронной оболочке семь электронов и которым для образования завершенной электронной оболочки не хватает одного электрона, предоставляет один неспаренный электрон для образования электронной пары, которая равномерно распределена между этими двумя атомами. У атома азота на внешнем электронном уровне находится 5 электронов, из которых три неспаренных, и ему не хватает 3 электронов для получения завершенной октетной оболочки. Каждый атом азота предоставляет по три электрона для образования трех электронных пар, которые также равномерно распределены между атомами и происходит образование тройной связи (кратная ковалентная связь). В случае разных атомов электронная плотность смещена в сторону более электроотрицательного атома, то есть к тому атому, который более сильно притягивает к себе электроны. В таком случае говорят о поляризации химической связи. В этом случае на одном из атомов, который более электроотрицателен, возникает частично отрицательный заряд, а на другом атоме - частично положительный заряд. Наглядным примером поляризованной ковалентной связи может служить молекула монооксида углерода - CO. Углерод и кислород предоставляют по 2 электрона для образования связи реализуя таким образом двойную связь. В то же время электронная плотность смещена в сторону атома кислорода как к более электроотрицательному атому и на нем формируется частичный отрицательный заряд. Соответственно на атоме углерода образуется частичный положительный заряд.
, каждый из атомов хлора, имеющих на внешней электронной оболочке семь электронов и которым для образования завершенной электронной оболочки не хватает одного электрона, предоставляет один неспаренный электрон для образования электронной пары, которая равномерно распределена между этими двумя атомами. У атома азота на внешнем электронном уровне находится 5 электронов, из которых три неспаренных, и ему не хватает 3 электронов для получения завершенной октетной оболочки. Каждый атом азота предоставляет по три электрона для образования трех электронных пар, которые также равномерно распределены между атомами и происходит образование тройной связи (кратная ковалентная связь). В случае разных атомов электронная плотность смещена в сторону более электроотрицательного атома, то есть к тому атому, который более сильно притягивает к себе электроны. В таком случае говорят о поляризации химической связи. В этом случае на одном из атомов, который более электроотрицателен, возникает частично отрицательный заряд, а на другом атоме - частично положительный заряд. Наглядным примером поляризованной ковалентной связи может служить молекула монооксида углерода - CO. Углерод и кислород предоставляют по 2 электрона для образования связи реализуя таким образом двойную связь. В то же время электронная плотность смещена в сторону атома кислорода как к более электроотрицательному атому и на нем формируется частичный отрицательный заряд. Соответственно на атоме углерода образуется частичный положительный заряд.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 444; Нарушение авторских прав?; Мы поможем в написании вашей работы!