
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Правило Хунда
|
|
|
|
ХУНДА ПРАВИЛА, приближенные правила, определяющие относит. расположение энергетич. уровней атома. Получены Ф. Хундом в 1927 в результате анализа атомных спектров.
Формулировка Хунда правил предполагает, что состояние многоэлектронного атома можно описать, указав т. наз. электронную конфигурацию - набор тех состояний, в к-рых находятся отдельные электроны. В общем случае данной электронной конфигурации отвечает неск. разных энергетич. состояний атома. Каждое из них в силу сферич. симметрии атома можно классифицировать по суммарному орбитальному моменту (квантовое число L = 0, 1, 2,... отвечает соотв. состояниям S, Р, D-типов), суммарному спину (квантовое число S) и полному моменту импульса атома как целого (квантовое число J, к-рое при заданных L и S меняется от L + S до |L - S | с шагом 1). Напр., атом С в низших состояниях можно описать электронной конфигурацией Is22s22p2; общее число состояний, отвечающих такой конфигурации, с учетом вырожденности нек-рых уровней равно 15. При стандартном обозначении символом 2S+lLj состояния атома С - 1S0,3P0,3Р1, 3Р2, 1D2.
Наиб. распространены след. Хунда правил:
1. Из состояний атома с заданной электронной конфигурацией ниже по энергии те, к-рые отвечают большим значениям S.
2. Из состояния атома с заданной конфигурацией и заданным спином S ниже по энергии те, к-рые отвечают большему значению L.
С Хунда правилами тесно связан важный для теории мол. орбиталей принцип заполнения: из неск. конфигураций молекулы ниже по энергии те, для к-рых сумма значений орбитальных энергий атомов меньше.
Хунда правила ограничены в осн. низколежащими состояниями атомов при условии, что влияние электронной корреляции (взаимной обусловленности движений электронов) достаточно мало и не нарушает границ применимости одноконфигурационного приближения (см.Конфигурационного взаимодействия метод). Основанием для выполнения первого правила является тесная связь между симметрией пространств. части волнoвой ф-ции атома и симметрией ее спиновой части, существующая согласно Паули принципу. По этой же причине первое Хунда правило обычно выполняется и для молекул.
Второе Хунда правило имеет более ограниченную применимость и определяется в осн. тем, насколько значимо межэлектронное отталкивание в анализируемых состояниях. Это правило выполняется иногда и для линейных молекул (при замене L на модуль проекции момента кол-ва движения на ось молекулы).
Для нек-рых типов состояний удается найти дополнит. правила, отвечающие изменению энергии атома при данной конфигурации и данных L и S в зависимости от J. Эти правила связаны со спин-орбитальным взаимодействием и др. тонкими эффектами. Напр., если в конфигурации есть лишь одна частично заполненная оболочка, то при заполнении оболочки менее чем на половину ("нормальный мультиплет") энергия растет с повышением J. В остальных случаях с ростом J энергия убывает ("обращенный мультиплет"). Так, для атома С описанные правила подтверждаются эксперим. значениями энергий возбуждения из основного состояния 3Р0: энергия перехода в, состояние 3Р1 равна 0,2 кДж/моль, в состояния 3Р2 - 0,5, 1D2 - 121,9, 1S0 - 259,0 кДж/моль.
Хунда правила часто нарушаются, т. к. одноконфигурационные модели атомов и молекул довольно редко бывают надежны. С появлением прецизионных эксперим. данных о спектрах атомов они теряют свое значение.
13. Периодичность изменения свойств элементов:
а) Радиус атомов и йонов
Атомные радиусы нужно применять в том случае, когда атомы соединены ковалентной или металлической связью. Это связывание осуществляется, если атомы приближаются друг к другу на расстояние, когда каждый атомный радиус примерно равен радиусу максимума радиальной плотности заряда.
Ионные радиусы используются в том случае, когда внешний электрон полностью удален с внешней орбитали электроотрицательного атома.
Периодичность атомных и ионных R. Для групп непероходных элементов атомные и ионные радиусы увеличиваются с увеличением порядкового номера (Z). Наибольшее увеличение имеет место для двух наиболее легких членов группы (Li и Be) и наименьшее для двух наиболее тяжелых членов группы. Но при изменении атомных и ионных радиусов по периодам они в общем уменьшаются при увеличении заряда ядра (Z). Наибольшее уменьшение наблюдается у элементов малых периодов, т.к. у них происходит заполнение внешнего электронного слоя. В больших периодах в пределах семейств d- и f- элементов наблюдается более плавное уменьшение радиусов. Это уменьшение называют соответственно d и f сжатием, (т.к. эти элементы имеют электроны, обладающие малой экранирующей способностью).
б)Энергия ионизации и ионизационный потенциал
Энергия ионизации — разновидность энергии связи или, как её иногда называют, первый ионизационный потенциал (I1), представляет собой наименьшую энергию, необходимую для удаления электрона от свободного атома в его низшем энергетическом (основном) состоянии на бесконечность.
Энергия ионизации является одной из главных характеристик атома, от которой в значительной степени зависят природа и прочность образуемых атомом химических связей. От энергии ионизации атома существенно зависят также восстановительные свойства соответствующего простого вещества.
Для многоэлектронного атома существуют также понятия второго, третьего и т. д. ионизационных потенциалов, представляющих собой энергию удаления электрона от его свободных невозбуждённых катионов с зарядами +1, +2 и т. д. Эти ионизационные потенциалы, как правило, менее важны для характеристики химического элемента.
Энергия ионизации всегда имеет эндоэнергетическое значение (это понятно, так как чтобы оторвать электрон от атома, требуется приложить энергию, самопроизвольно это произойти не может).
На энергию ионизации атома наиболее существенное влияние оказывают следующие факторы:
эффективный заряд ядра, являющийся функцией числа электронов в атоме, экранирующих ядро и расположенных на более глубоко лежащих внутренних орбиталях;
радиальное расстояние от ядра до максимума зарядовой плотности наружного, наиболее слабо связанного с атомом и покидающего его при ионизации, электрона;
мера проникающей способности этого электрона;
межэлектронное отталкивание среди наружных (валентных) электронов.
На энергию ионизации оказывают влияние также и менее значительные факторы, такие, как квантовомеханическое обменное взаимодействие, спиновая и зарядовая корреляция и др.
Энергии ионизации элементов измеряется в Электронвольт на 1 атом или в Джоуль на моль.
в) Сродство к Электрону
СРОДСТВО КЭЛЕКТРОНУ частицы (молекулы, атома, иона), миним. энергия А, необходимая для удаления электрона из соответствующего отрицат. иона на бесконечность. Для частицы X сродство к электрону относится к процессу:

Сродство к электрону равно энергии ионизации E отрицат. иона X-(первому потенциалу ионизации U1, измеряется в эВ). По аналогии с потенциалом ионизации различают первое и второе сродство к электрону, а также вертикальное и адиабатическое сродство к электрону многоатомной частицы. Термодинамич. определение сродства к электрону-стандартная энтальпия 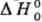 р-ции (1) при абс. нуле т-ры:
р-ции (1) при абс. нуле т-ры:
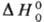 = АNА (NА~постоянная Авогадро).
= АNА (NА~постоянная Авогадро).
Надежных эксперим. данных по сродству к электрону атомов и молекул до сер. 60-х гг. 20 в. практически не существовало. В настоящее время использование равновесных методов получения и исследования отрицат. ионов позволило получить первые сродства к электрону для большинства элементов периодич. системы и неск. сотен орг. и неорг. молекул. Наиб. перспективные методы определения сродства к электрону-фотоэлектронная спектроскопия (точность + 0,01 эВ) и масс-спектрометрич. исследование равновесий ионно-молекулярных реакций. Квантовомех. расчеты сродства к электрону аналогичны расчетам потенциалов ионизации. Наилучшая точность для многоатомных молекул составляет 0,05-0,1 эВ.
Наибольшим сродством к электрону обладают атомы галогенов. Для ряда элементов сродство к электрону близко к нулю или меньше нуля. Последнее означает, что для данного элемента устойчивого отрицат. иона не существует. В табл. 1 приведены значения сродства к электронуатомов, полученные методом фотоэлектронной спектроскопии (работы У. Лайнебергера с сотрудниками).
Сродство к электрону молекул составляет, как правило, От 0 до 4 эВ (табл. 2).
Обнаружены молекулы с очень высокими значениями сродства к электрону-гекса-, пента- и тетрафториды переходных металлов. Наибольшим из известных в настоящее время значений сродства к электрону обладает PtF6 (7,00 b 0,35 эВ).
Сродство к электрону определяет окислит. способность частицы. Молекулы с высокими значениями сродства к электрону-сильные окислители. С их помощью были получены хим. соед. благородных газов, соед. внедрения в графите.
Существование многозарядных (Двух- и более) многоатомных отрицат. ионов в основном состоянии в газовой фазе до сих пор экспериментально не подтверждено. Возможен лишь квантовомех. расчет или расчет по циклу Борна-Габера второго или более высокого сродства к электрону длямолекул. Для ряда молекул второе сродство к электрону, полученное таким способом, является существенно положительным (PtF6 3,8 эВ, CrF6 2,44 эВ).
г) Электроотрицательность
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ, величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А.
Л. Полинг предложил (1932) для количеств. характеристики электроотрицательности использовать термохим. данные об энергии связей А—А, В — В и А — В - соотв. ЕАА, Евв и ЕАВ. Энергия гипотетической чисто ковалентной связи А — В (Еков) принимается равной среднеарифметич. или среднегеометрич. значению величин EAA и ЕВВ. Если электроотрицательности атомов А и В различны, то связь А — В перестает быть чисто ковалентной и энергия связи ЕАВ станет больше Ековна величину 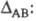
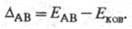
Чем больше различие электроотрицательностей 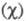 атомов А и В, тем больше величина
атомов А и В, тем больше величина 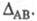 Используя эмпирич. ф-лу
Используя эмпирич. ф-лу 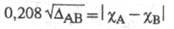 (множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности
(множитель 0,208 возникает при переводе значений энергии из ккал/моль в эВ) и принимая для атома водорода произвольное значение электроотрицательности 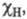 равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
равное 2,1, Полинг получил удобную шкалу относит. числовых значений электроотрицательности, часть к-рых приведена в табл. Наиб. электроотрицателен самый легкий из галогенов - F, наименее - тяжелые щелочные металлы.
Для количеств. описания электроотрицательности, помимо термохим. данных, используют также данные о геометрии молекул (напр., метод Сандерсона), спектральные характеристики (напр., метод Горди).
д) Окислительно-восстановительный способности
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — red uction- ox idation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) вокислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2221; Нарушение авторских прав?; Мы поможем в написании вашей работы!