
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория активированного комплекса
|
|
|
|
Влияние температуры на скорость реакции: уравнение Аррениуса. Энергия активации. Понятие об активированном комплексе. Методы расчета энергии активации. Теория активных столкновений. Уравнение Эйринга. Константа равновесия
Влияние Т на скорость хим. реакций. Основное влияние Т оказывает на константу скорости. Вант-Гофф установил, что при повышении Т на 10К скорость реакции увеличивается в 2-4раза, температурный коэффициент скорости реакции Вант-Гоффа:  . Правило было установлено для реакций, протекающих в растворах при сравнительно низких Т (0…120С). При повышении Т g уменьшается и стремится к 1. Если известны Т1 и скорость при ней:
. Правило было установлено для реакций, протекающих в растворах при сравнительно низких Т (0…120С). При повышении Т g уменьшается и стремится к 1. Если известны Т1 и скорость при ней:  . Уравнение Аррениуса:
. Уравнение Аррениуса:  , Ea- аррениусовская или опытная Е активации, k0-предэкс. множ-ль, мало зависящий от Т. Можно представить в логарифмической форме (для построения графика зав. lnk от 1/T). Ea можно вычислить по значениям константы скорости, измеренным при неск. разн. т-рах. Еа можно так же оценить, если известны константы скорости при 2х Т, Т1 и Т2. Берем два логарифмических Ур-ия (k1, k2, T1, T2), вычитаем и выражаем Еа:
, Ea- аррениусовская или опытная Е активации, k0-предэкс. множ-ль, мало зависящий от Т. Можно представить в логарифмической форме (для построения графика зав. lnk от 1/T). Ea можно вычислить по значениям константы скорости, измеренным при неск. разн. т-рах. Еа можно так же оценить, если известны константы скорости при 2х Т, Т1 и Т2. Берем два логарифмических Ур-ия (k1, k2, T1, T2), вычитаем и выражаем Еа: 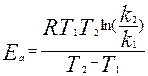 .
.
Еа представляет собой избыток энергии (в расчете на 1 моль) по сравнению со средней Е молекул при данной Т, необходимый для того, чтобы реагирующие частицы могли вступить в хим. реакцию и определяется св-вами реаг-х ч-ц, их Е состоянием. Дифференциальное уравнение Аррениуса: дифференцируем логарифмическое по Т, откуда получаем, что чем больше Еа, тем быстрее увеличивается k с возрастанием Т.
Теория активных столкновений: реакция осуществляется в момент столкновения 2х молекул А и В, столкновение молекул приводит к хим. превращению только в том случае, когда молекулы А и В обладают достаточно большим запасом Е. (она необходима для преодоления сил отталкивания) Число 2-х соударений:  ,
,  - приведенная масса молекул, sАВ=(sА+sВ)/2, sA, sB – диаметры молекул, nA, nB – число соотв. молекул в ед. объема. Константа скорости реакции второго порядка:
- приведенная масса молекул, sАВ=(sА+sВ)/2, sA, sB – диаметры молекул, nA, nB – число соотв. молекул в ед. объема. Константа скорости реакции второго порядка: 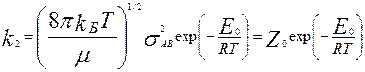 , Ео- истинная Еа. Там всякие преобразования,В итоге связб Еа и Ео: Еа=Ео+1/2RT. Различие между этими Е мало…
, Ео- истинная Еа. Там всякие преобразования,В итоге связб Еа и Ео: Еа=Ео+1/2RT. Различие между этими Е мало…
В ТАК для любой элем. р-ции предполагается, что начальная конфигурация атомов переходит в конечную в результате непрерывного изменения межъядерных расстояний. Например, в ходе элем. р-ции: А+ВС->АВ+С сближаются атомы А и В, поэтому расстояния Rab уменьшается, Rbc увеличивается. В соотв. с этой теорией на 1 этапе строят поверхность пот. энергии системы. Установлено, что подобн. реак. осущ. с наим. затр. Е, если атомы расп. на лин., соед. их центры. В проц. непр. изменения межъяд. расст. всегда образуется промеж-я конфиг. А…В…С, в кот. связь В-С уже ослаблена, но еще полностью не разорвана, а связь А-В уже начала образовыватся. такая конфигурация является критической для данной реакции. Продукты реакции могут появиться только при условии обр-я этой конфигурации, кот. наз. переходным состоянием или активированным комплексом. Кин. схема для элем. р-ции имеет вид: 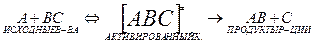 . ОСНОВНОЙ постулат теории АК: исходные в-ва всегда находятся в равновесии с АК. Константа скорости р-ции:
. ОСНОВНОЙ постулат теории АК: исходные в-ва всегда находятся в равновесии с АК. Константа скорости р-ции: 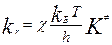 , c- трансмиссионный коэффициент (учитывает вероятность перехода АК в продукты р-ции). Константа равновесия:
, c- трансмиссионный коэффициент (учитывает вероятность перехода АК в продукты р-ции). Константа равновесия: 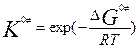 . Уравнение Эйринга:
. Уравнение Эйринга: 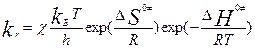 … (энтропия и энтальпия активации). Это Ур-ие справедливо для мономолек. р-ций в газовой фазе и растворах.
… (энтропия и энтальпия активации). Это Ур-ие справедливо для мономолек. р-ций в газовой фазе и растворах.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1168; Нарушение авторских прав?; Мы поможем в написании вашей работы!