
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Константа диссоциации. Закон разбавления Оствальда
|
|
|
|
Сильные и слабые электролиты. Степень диссоциации.
Аррениус объяснил, что лишь часть электролита диссоциирует в растворе на ионы, и ввел понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
Позже было установлено, что электролиты можно разделить на две группы: сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически нацело. Понятие степени диссоциации к ним по существу неприменимо, а отклонение изотонического коэффициента I от целочисленных значений объясняется другими причинами. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоцииро-ванными молекулами и нонами.
К сильным электролитам принадлежат почти все соли; из важнейших кислот и оснований к ним относятся HN03, H2S04, НСЮ4, НС1, НВг, HI, КОН, NaOH, Ва(ОН)2 и Са(ОН)2.
К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СОз, H2S, HCN, H2Si03 и NH4OM.
Степень диссоциации принято обозначать греческой буквой а и выражать либо в долях единицы, либо в процентах.
Константа диссоциации представляет собой константу равновесия процесса диссоциации:

где [A+], [B-], [AB] – равновесные концентрации катионов, анионов и недиссоциированных молекул электролита соответственно. Константа диссоциации зависит от природы растворителя, электролита и внешних условий – температуры и давления.
Степень диссоциации и константа диссоциации связаны между собой. Если исходная концентрация электролита С, а степень диссоциации 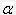 , то концентрации катионов и анионов в состоянии равновесия
, то концентрации катионов и анионов в состоянии равновесия 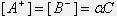 , равновесная концентрация недиссоциированных молекул электролита
, равновесная концентрация недиссоциированных молекул электролита 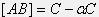 , тогда
, тогда
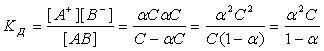
Если электролит слабый, т. е. 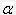 <<1, то и
<<1, то и 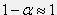 , следовательно
, следовательно
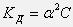
Это соотношение носит название закона разведения Оствальда. Если выразить из него степень диссоциации
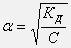
то видно, что с уменьшением концентрации раствора (разбавление раствора) степень диссоциации электролита возрастает.
Многоосновные кислоты и многокислотные основания в водных растворах диссоциируют ступенчато, т.е. вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая такая ступень характеризуется своей константой – ступенчатой константой диссоциации (для комплексных соединений – константой нестойкости).
Например, серная кислота H2SO4 – сильная двухосновная кислота, диссоциирует в две ступени.
I ступень: H2SO4 ↔ H+ + HSO4¯
II ступень: HSO4¯ ↔ H+ + SO42–
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1812; Нарушение авторских прав?; Мы поможем в написании вашей работы!