
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Направление химической реакции. Принципиальная возможность протекания процесса
|
|
|
|
Энергия Гиббса. Стандартные значения свободной энергии.
Понятие энтропии. Стандартные значения энтропии, изменение энтропии в химической реакции.
Энтропия (S) – функция состояния, мера неупорядоченности системы, пропорциональная логарифму числа равновероятных микросостояний, которыми может быть реализовано данное микросостояние. Энтропия имеет размерность энергии, деленной на температуру; обычно ее относят к 1 молю вещества (мольная энтропия) и выражают в Дж/(моль*К). Из определения ясно, что энтропия возрастает при переходе вещества из кристаллического состояния в жидкое, из жидкого в газообразное, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц – в первую очередь, частиц в газообразном состоянии.
Для энтропии справедливо высказывание, аналогичное энтальпии: изменение энтропии системы в результате химической реакции равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ.
Энергия Гиббса – функция состояния, одновременно отражающая влияние на направление протекания процесса как тенденции к уменьшению внутренней энергии, так и тенденции к достижению наиболее вероятного состояния системы, связанная с энтальпией и энтропией: G=H-T*S.
В условиях постоянства температуры и давления реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса (ΔG<0). Иначе говоря, при низких температурах наиболее вероятно самопроизвольное протекание экзотермических реакций, даже если при этом энтропия системы уменьшается, а при высоких температурах наиболее вероятно протекание реакций, сопровождающихся возрастанием энтропии, в том числе и эндотермических реакций.
Стандартной молярной свободной энергией образования называется изменение свободной энергии Гиббса, которым сопровождается образование одного моля вещества из входящих в него элементов в их стандартных состояниях. Свободная энергия Гиббса измеряется в тех же единицах, что и обычная энергия; размерность молярной свободной энергии: кДж/моль.
В химических процессах одновременно действуют два противоположных фактора — энтропийный (TΔS) и энтальпийный (ΔH). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (G):
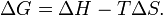
Из этого выражения следует, что 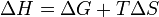 , то есть некоторое количество теплоты расходуется на увеличение энтропии (TΔS), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (ΔG) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
, то есть некоторое количество теплоты расходуется на увеличение энтропии (TΔS), эта часть энергии потеряна для совершения полезной работы, её часто называют связанной энергией. Другая часть теплоты (ΔG) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При ΔG < 0 процесс может протекать, при ΔG > 0 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же ΔG = 0, то система находится в состоянии химического равновесия.
Существует полезное соотношение, связывающее изменение свободной энергии Гиббса 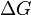 в ходе химической реакции с её константой равновесия
в ходе химической реакции с её константой равновесия  :
:
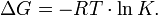
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
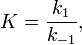
где 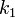 — константа скорости прямой реакции,
— константа скорости прямой реакции,  — константа скорости обратной реакции.
— константа скорости обратной реакции.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 991; Нарушение авторских прав?; Мы поможем в написании вашей работы!