
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость и произведение растворимости
|
|
|
|
Общая характеристика растворов. Способы выражения концентрации растворов.
Раствор – твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Всякий раствор состоит из растворителя, растворенных веществ и продуктов их взаимодействия.
По содержанию растворенных веществ растворы классифицируются на разбавленные (малое содержание растворенного вещества) и концентрированные (высокое).
По количеству растворенного вещества относительно предела его растворимости классифицируются на: насыщенные (раствор, находящийся в равновесии с растворяющимся веществом) и ненасыщенные (раствор содержит меньше растворенного вещества, чем его содержит при данной температуре насыщенный).
Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами – долями или процентами, либо величинами размерными – концентрациями:
· Массовая доля (C) – процентное отношение массы растворенного вещества к общей массе раствора.
· Мольная доля (Ni) – отношение количества растворенного вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе.
· Молярная концентрация, или молярность (Cм) – отношение количества растворенного вещества к объему раствора, (моль/л).
· Молярная концентрация, или молярность (m) – отношение количества растворенного вещества к массе растворителя, (моль/кг).
· Эквивалентная концентрация, или нормальность (Cн или N) – отношение числа эквивалентов растворенного вещества к объему раствора, (моль/л). N к-ты= Cм*(основность к-ты); N основания= Cм*(кислотность основания); N соли= Cм*(основность к-ты)*(число кислотных остатков).
Эквивалент – такое количество вещества, которое взаимодействует (присоединяет, выделяет, замещает) 1 моль атомов водорода.
Растворимость – способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях служит содержание его в насыщенном растворе. Обычно растворимость твердых веществ и жидкостей выражают значением коэффициента растворимости (S), т.е. массой вещества, растворяющегося при данных условиях в 100 г растворителя с образованием насыщенного раствора.
Растворимость газов часто характеризуют коэффициентом абсорбации, который выражает объем газа, растворяющегося в одном объеме растворителя с образованием насыщенного раствора.
Закон Генри: масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению газа. Из закона Генри следует, что объем растворяющегося газа (а значит, и коэффициент абсорбации) не зависит при данной температуре от парциального давления газа.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:

Константа этого равновесия рассчитывается по уравнению:

В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:
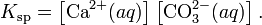
Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:

где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 6323; Нарушение авторских прав?; Мы поможем в написании вашей работы!