
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие. Константы равновесия. Смещение равновесий. Принцип Ла-Шателье
|
|
|
|
Все реакции делятся на две группы: необратимые и обратимые реакции. Необратимые протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении, а обратимая – как в прямом, так и обратном направлении.
Химическое равновесие – момент в протекании реакции, когда скорости прямой и обратной реакции становятся одинаковыми. Для обратимой системы оно характеризуется:
· Равенством скоростей прямой и обратной реакций.
· Постоянством концентраций всех реагирующих веществ во времени, а, следовательно, отсутствием видимых изменений.
· Постоянной величиной свободной энергии.
· Величиной константы ХР: 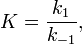 где
где 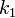 — константа скорости прямой реакции,
— константа скорости прямой реакции,  — константа скорости обратной реакции.
— константа скорости обратной реакции.
Химическое равновесие называют динамическим равновесием – число частиц, образующихся в единицу времени при прямой реакции, равно числу частиц, вступивших во взаимодействие при обратной реакции.
При равновесии скорости прямой и обратной реакций равны друг другу, при этом в системе устанавливаются постоянные концентрации исходных веществ и продуктов реакции, называемые равновесными концентрациями. Они обозначаются квадратными скобками.
Смещение химического равновесия происходит при изменении различных условий в системе: изменения концентрации какого-либо из веществ, участвующих в реакции, давления или температуры:
· Изменение концентрации: при увеличении концентрации какого-либо из реагирующих веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
· Изменение давления: при увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
· Изменение температуры: при повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической реакции.
Принцип Ла-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 634; Нарушение авторских прав?; Мы поможем в написании вашей работы!