
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Представление о скорости химических реакций. Зависимость скорости от природы и концентрации реагирующих веществ, температуры. Катализ и катализаторы
|
|
|
|
Окислительно-восстановительные процессы. Степень окисления элемента. Окисление и восстановление как процессы присоединения и отдачи электронов. Практическое использование окислительно-восстановительных процессов.
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе учения о строении атомов. Структура периодической системы. Изменение свойств химических элементов и их соединений по группах и периодах периодической системы.
Строение атома. Состав атомных ядер. Физический смысл порядкового номера химического элемента. Изотопы. Явление радиоактивности. Электронное строение атома. Понятие об электронном облаке. Атомная электронная орбиталь. Энергетический уровень и подуровень. S-, p-, d-орбитали в атоме. Строение электронных оболочек атомов на примере элементов 1-го, 2-го, 3-го периодов периодической системы.
Атом любого элемента состоит из ядра и и электронной оболочки (QA = 0, QЯ = 1, MЯ = 1). Ядро состоит из протонов (Q = 1)и нейтронов (Q = 0). Количество протонов равно порядковому номеру элемента. Число нейтронов в ядре равно разности между массовым числом изотопа и порядковым номером.
Массовое число – сумма количества нейтронов и протонов в ядре. Оно получается округлением относительной атомной массы изотопа до целого числа.
Атомы одного элемента с разными числами нейтронов в ядре называются изотопами (Протий – 1p0n, Дейтерий – 1p1n, Тритий – 1p2n, Квадрий – 1p3n).
Число электронов в электронной оболочке равно заряду ядра (или порядковому номеру элемента). Электроны в атоме различаются энергией, формой электронных облаков, размерами электронных облаков, расположением их в пространстве.
Устойчивому состоянию ядер атомов соответствуют определенные соотношения чисел нейтронов и протонов. При нарушении устойчивого протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным. Радиоактивность – самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц. Основными типами радиоактивного распада являются α-распад и β-распад.
Чем больше расстояние от ядра до электрона, тем выше энергия последнего. Все электроны с одинаковым запасом энергии образуют один энергетический уровень. Число энергетических уровней в атоме равно номеру периода.
 |  |  |  | ||||||
 | |||||||||
В пределах одного уровня электроны могут иметь различную форму облаков. Электронное облако – область околоядерного пространства, в которой вероятность пребывания электрона равна 90-95%. Электроны одного уровня с одинаковой формой облаков образуют один энергетический подуровень. Число подуровней на данном уровне равно его номеру.
S P D F
Электроны одного подуровня различаются расположением электронных облаков в пространстве. Каждому варианту расположения соответствует одна орбиталь.
S – 1
P – 3
D – 5
F – 7
S: P:
 y y
y y
 z z
z z

 | |||
 | |||
D:
 |  |


 | |||
 | |||
 |  |


 |  |

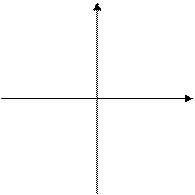
Атомы разных элементов с одинаковым числом нейтронов в ядре называются изотонами (K и Ca). Атомы элементов с одинаковыми массами называются изобарами.
Каждый электрон в атоме характеризуется четырьмя квантовыми числами: n – главное, l – орбитальное (побочное), m – магнитное, ms – спиновое. Главное квантовое число характеризует энергию электронов на данном уровне и размер электронного облака: чем больше значение n, тем больше энергия электронов и размер электронного облака. Число n изменяется от 1 до 7. Значение n данного электрона равно номеру уровня, на котором он находится.
О))))
1 2 3 4
Орбитальное квантовое число характеризует форму электронного облака и принимает значения от 0 до n–1. Число значений l равно числу подуровней на данном уровне:
L – 0 1 2 3 4
s p d f g
Магнитное квантовое число характеризует расположение облаков в пространстве и принимает значения + l….0….- l. Число значений m равно числу орбиталей в главном подуровне:
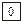
S l=0 m=
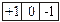
P l=1 m=
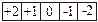
D l=2 m=
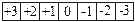
F l=3 m=
Спиновое квантовое число характеризует собственный момент количества движения электрона и принимает значения +1/2 и –1/2. Спин – чисто квантовое понятие, не имеющее аналогов в макромире. Это собственный момент импульса электрона, не связанный с движением в пространстве.
Принцип минимальной энергии – атомные орбитали заполняются электронами последовательно с увеличением суммы n+l:
1s—→2s—→2p—→3s—→3p—→3d—→4s—→4p—→4d—→….
1+02+02+13+03+13+24+04+14+2
1 2 3 3 4 5 4 5 6
Если сумма n+l для двух орбиталей одинакова, то в первую очередь заполняется орбиталь с меньшим n.
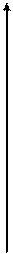 
| 7s | 7p | |||||||||||
| ã | ã | ||||||||||||

| 6s | 6p | 6d | 6f | 6g | 6h | |||||||
| ã | ã | ã | |||||||||||

| 5s | 5p | 5d | 5f | 5g | ||||||||
| У | ã | ã | ã | ||||||||||
 Р Р
| 4s | 4p | 4d | 4f | |||||||||
| О | ã | ã | |||||||||||
| В | 3s | à | 3p | 3d | |||||||||
| Н | ã | ||||||||||||
| И | 2s | à | 2p | ||||||||||
| á | |||||||||||||
| 1s | |||||||||||||

| |||||||||||||
| S | P | D | F | G | H | ||||||||
| П | О | Д | У | Р | О | В | Н | И |
Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями их квантовых чисел. Электроны должны различаться одним, двумя или тремя квантовыми числами обязательно!
Принцип Хунда: суммарный спин подуровня должен быть максимальным по абсолютной величине.
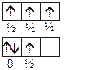 |
2p³:
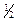 Явление проскока электрона наблюдается в атомах Cu, Cr, Mn, Ag, Mo, Nb и др.
Явление проскока электрона наблюдается в атомах Cu, Cr, Mn, Ag, Mo, Nb и др.
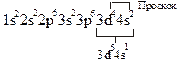 24Cr))))
24Cr))))
s s s s
p p p
d d
f
С развитием науки элементов открывали все больше и больше, причем некоторые из них имели сходные свойства. Появилась необходимость упорядочить, классифицировать их, т. к. это позволило бы более основательно изучать свойства элементов и их соединений. Вначале попытались классифицировать элементы, положив в основу их химические и физ. свойства. Однако эти попытки не привели к желаемым результатам. Правильно подошел к этому вопросу Д. И. Менделеев. Он обратил внимание, что атомный вес объединяет и связывает отдельные элементы между собой, и положил его в основу классификации. Располагая известные в то время элементы в порядке возрастания атомных весов, Д. И. Менделеев обнаружил, что свойства элементов периодически повторяются. В 1869 г. он сформулировал свой закон:
Свойства простых веществ, а также формы и свойства соединений химических элементов находятся в периодической зависимости от величины их атомных весов.
В 1913 г. английский ученый Мозли открыл, что важнейшей характеристикой химического элемента является не атомная масса, а заряд ядра, который совпадает с порядковым номером. Поэтому в настоящее время закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов их атомных ядер.
Графическим изображением периодического закона является периодическая таблица. Формы такого изображения различны: их насчитывается около 500, однако подход к построению таблиц единый - элементы располагаются в порядке возрастания заряда их атомных ядер.
Периодом в периодической системе называется последовательный ряд элементов, электронная конфигурация ВЭУ которых изменяется от ns1 до ns2np6. При этом номер периода совпадает со значением главного квантового числа n ВЭУ. Каждый из периодов (кроме 1) начинается типичным металлом и заканчивается благородным газом, которому предшествует неметалл.
В вертикальных колонках, называемых группами объединены элементы, имеющие сходное электронное строение. Каждая группа состоит из главной и побочной подгрупп. Элементы, расположенные в одной подгруппе, называются аналогами и имеют сходные строения ВЭУ при разных значениях n и поэтому проявляют сходные химические свойства. Элементы главных и побочных подгрупп различаются своими химическими свойствами, но их объединяет номер группы. Он, как правило, указывает число электронов, участвующих в образовании химических связей. У элементов главных подгрупп валентными являются только электроны ВЭУ, а у элементов побочных подгрупп – и электроны предвнешних уровней. Это основное различие между элементами гл. и побочных подгрупп.
Периодически изменяются радиусы атомов, энергия ионизации, сродство к электрону и электроотрицательность:
1.Радиус: 2.Еион: 3.Еср 4.Электроотрицательность:

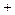
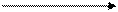

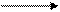

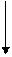


 | |||||||
 |  | ||||||
 | |||||||
Периодический закон сыграл большую роль в развитии химии. Он помог установить взаимную связь между элементами и объединить их по свойствам, расположить элементы в естественной последовательности, исправить и уточнить атомные массы, предсказать существование новых элементов.
Периодическая система помогает определить состав и формулы химических соединений. Она является выражением общего закона природы – закона развития в неорганическом мире.
Периодический закон – величайшее открытие человечества!
Природа и типы химической связи. Образование ковалентной связи на примере молекул водорода, хлороводорода и аммиака. Полярная и неполярная ковалентные связи. Донорно-акцепторный механизм образования ковалентной связи на примере иона аммония. Ионная связь. Водородная связь. Примеры химических соединений с разными видами связи.
Химическая связь – взаимодействие, связывающее атомы в молекулы, кристаллы или радикалы, а также ионы в ионные радикалы. Природа ХС –электрическая. Т. к. связь образуется за счет валентных электронов. Механизм образования связи – квантово-механический. Расчеты показали, что связь образуется за счет перекрывания эл. облаков и образования общей эл. плотности между атомами. Типы химической связи определяются разностью в значениях ЭО связанных атомов: ΔЭО = 0 – ковалентная неполярная; 0<ΔЭО<2 – ковалентная полярная; ΔЭО>2 – ионная. Ковалентная связь характеризуется энергией Е, длиной l, кратностью k, полярностью, насыщаемостью, направленностью. Энергия связи – это энергия, которая выделяется при образовании 1 моль связи или поглощается при разрыве 1 моль связи. Чем больше энергия, тем прочнее связь. Длина связи – расстояние между ядами атомов в молекуле. Кратность – число общих электронных пар. Полярность связи определяется смещением ОЭП к одному из атомов. Количественно полярность выражается через дипольный момент m (m = |q|∙l). Чем больше m, тем полярнее связь. Насыщаемость – способность атома соединяться с др. атомом определенным числом связей, которое определяется числом валентных электронов. Направленность определяется величиной угла между направлениями связей в пространстве. Существуют два вида образования связи: обменный и донорно-акцепторный. Ионная связь, в отличие от ковалентной, является ненаправленной и ненасыщаемой. Ненаправленность ионной связи заключается в том, что каждый ион создает вокруг себя электрическое поле, силовые линии которого направлены во все стороны от него, поэтому любой положительный ион притягивает к себе множество отрицательных ионов, образуя кристалл. Никогда нельзя определить направление ионной связи: она действует сразу во всех направлениях. Например, в кристалле NaCl каждый ион натрия окружен 8-ю ионами хлора, и каждый ион хлора окружен 8-ю ионами натрия.
Особыми типами связей является водородная и металлическая связи. Водородная связь осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы: Х – Н ∙∙∙ Х –, где Х – атом F, O, N, реже Cl, S. Возникновение ВС обусловлено тем, что у атома водорода имеется только один электрон, который при образовании ковалентной связи с сильно электроотрицательным элементом смещается в сторону этого элемента. На атоме водорода возникает эффективный положительный заряд, что в сочетании с отсутствием внутренних электронных слоев позволяет другому атому сближаться до расстояний, близких к длинам атомных связей. Наличие ВС влияет на физические и химические свойства веществ. В частности, аномально высокие температуры плавления и кипения. С повышением температуры число ВС сокращается.
Металлическая связь – особый тип химической связи, напоминающей как ионную, так и ков. полярную связи. В основе образования МС лежит возникновение «электронного газа». Небольшая часть атомов (3-5%) теряют свои валентные электроны (обычно с s-подуровня). Облака свободных электронов перекрываются и образуют одно электронное облако, занимающее весь объем кристалла. «Электронный газ», заряженный в целом отрицательно, удерживает в кристалле катионы металлов. Этот тип связи встречается во всех металлах, а также в некоторых карбидах.
Вид связи определяется формой перекрывающихся облаков и характером их перекрывания: σ-связь образуется, если области перекрывания лежат на линии, соединяющей центры атомов; π-связь образуется, если область перекрывания находится выше и ниже линии связи; δ-связь образуется при перекрывании двух d-облаков в 4-ех точках пространства.
Классификация химических реакций по различным оценкам. Типы химических реакций: соединения, разложения, замещения, обмена. Тепловой эффект химической реакции. Термохимические уравнения.
Химическая реакция – процесс, при котором из одних веществ получаются другие. В общем виде уравнение химической реакции можно записать следующим образом:
а1А1 + а2А2 +… → b1В1 + b2В2 +…
Здесь, А1, А2 называются реагентами, В1, В2 – продуктами, а числа а1, а2, b1, b2 – стехиометрическими коэффициентами. Химические реакции классифицируются различными способами. При этом классификации делится на феноменологические, когда за основу берется некий наблюдаемый параметр, и по механизму реакции.
Феноменологические классификации
1.По виду взаимодействия:
а) разложения 2H2O2 → 2H2O + O2
б) соединения H2 + I2 → 2HI
в) замещения Fe + CuCl2 → FeCl2 + Cu
г) обмена Na2SO4 + BaCl2 → 2NaCl + BaSO4
2. По изменению СО участвующих в реакции веществ:
а) ОВР 2HgO → 2Hg + O2
б) без изменения СО HgO + 2HCl → HgCl2 + H2O
3. По полноте протекания процесса:
а) необратимые 2H2О2 →2H2O + O2
б) обратимые 3H2 + N2 == 2NH3
4. По тепловому эффекту:
а) экзотермические P2O3 + 3H2O → 2H3PO4 + Q
б) эндотермические N2 + O2 → 2NO – Q
Все химические реакции можно разделить на 2 группы. К первой из них относятся реакции, протекающие без изменения степени окисления атомов элементов, входящих в состав реагирующих веществ. Ко второй группе относятся реакции, идущие с изменением степени окисления атомов реагирующих веществ. Такие реакции носят название окислительно-восстановительных реакций. ОВР – самые распространенные и играют большую роль в природе и технике. Окислением называется процесс отдачи электронов атомом, молекулой или ионом. При окислении степень окисления повышается. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом. При восстановлении степень СО понижается. Атомы, молекулы или ионы, отдающие электроны называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстановляются. Восстановители и окислители могут быть как простыми веществами, так и сложными. Металлы содержат на ВЭУ 1 – 2 электрона. Поэтому в химических реакциях оно отдают валентные электроны, т.е. окисляются и проявляют восстановительные свойства. В периодах с повышением порядкового номера восстановительные свойства понижаются, а окислительные – возрастают. У элементов главных подгрупп окислительные свойства ослабевают и усиливаются восстановительные с ростом порядкового номера. Элементы побочных подгрупп имеют металлический характер, поэтому проявляют восстановительные свойства. Неметаллы могут быть как окислителями, так и восстановителями. Важнейшими восстановителями являются: металлы, водород, углерод, оксид углерода (II), сероводород, оксид серы (IV), сернистая кислота и ее соли, галогенводородные кислоты, хлорид олова (II), сульфат железа (II), сульфат марганца (II), сульфат хрома (III), азотистая кислота, аммиак, гидразин, оксид азота (II), фосфористая кислота, альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза, катод при электролизе. Важнейшие окислители – галогены, перманганат калия, манганат калия, оксид марганца (IV), азотная кислота, кислород, озон, пероксид водорода, концентрированная серная кислота, оксиды меди (II), серебра (I), свинца (IV), хлорид железа (III), гипохлориты, хлораты и перхлораты, «царская водка», анод при электролизе.
ОВР классифицируются по нескольким признакам:
1. По числу элементов, атомы которых меняют СО:
1) 1 элемент: KClO3 ® KCl + KClO4
2) 2 элемента: CuS + O2 ® CuO + SO2
3) 3 элемента: FeS + O2 ® Fe2O3 + SO2
2. По принадлежности атомов окислителя и восстановителя одному или нескольким элементам:
1) в одном веществе: NH4NO3 ® N2O + H2O
2) в разных веществах: H2S + HNO3 ® H2SO4 + NO2 + H2O
3. По способу изменения СО одного элемента:
1) Диспропорционирования: Эy Эx ® Эz
KClO3 ® KCl + KClO4 Cl-1 Cl+5 ® Cl+7
2) компропорционирования: Эy ® Эx Эz
NH3 + NO2 ® N2 + H2O N-3 ® N0 N+4
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени. Рассмотрим в общем виде скорость реакции, протекающей по уравнению:
A + B → C + D.
По мере расхода вещества А скорость реакции уменьшается. Отсюда следует, что скорость реакции может быть определена лишь для некоторого промежутка времени. Так как, концентрация вещества А в момент времени t1 измеряется величиной с1, а в момент времени t2 – величиной с2, то за время Δt= t2 - t1 концентрация изменится на Δс= с2 - с1:
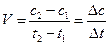
Обычно скорость измеряется в моль/л·с.
Поскольку скорость все время изменяется, то в химической кинетике рассматривают только истинную скорость, т.е. скорость в данный момент времени. При рассмотрении скорости необходимо различать реакции, протекающие в гомогенной и гетерогенной системе. Гомогенной системой называется система, состоящая из одной фазы. Гетерогенная система состоит из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком. Если реакция идет в гомогенной системе, то она идет во всем объеме этой системы. Если реакция протекает в гетерогенной системе, то она может идти только на поверхность раздела. В связи с этим скорость определяется различно. Скорость гомогенной реакции определяется количеством вещества, вступающего в реакцию или образующегося при реакции в единицу времени в единице объема:

Скорость гетерогенной реакции определяется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени на единице поверхности фазы:
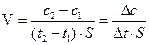
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции, важнейшими из которых являются концентрация, температура и присутствие катализатора. Чтобы осуществить химическое взаимодействие, необходимо, чтобы вещества А и В столкнулись. Чем больше столкновений, тем быстрее идет реакция. Число столкновений тем выше, чем больше концентрация. Следовательно, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Для реакции A +B = C + D этот закон выразится уравнением:
V = k∙c[A]∙c[D].
Этот закон химической кинетики назван законом «Действующих масс». Константа скорости k зависит от природы реагирующих веществ и температуры, но не зависит от концентрации! Зависимость скорости реакции от температуры отражается правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза:
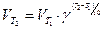
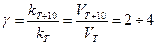
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Изменение скорости под действием температуры связано с тем, что неактивные молекулы превращаются в активные, обладающие энергией для осуществления данной реакции. Эта энергия называется энергией активации.
Другой способ регулирования скорости – применение катализаторов. Катализаторы – вещества, которые ускоряют химическую реакцию путем многократного участия в промежуточном химическом взаимодействии с реагентами, но после каждого цикла восстанавливающие свой химический состав. Различают положительные катализаторы, которые ускоряют реакцию, и отрицательные катализаторы (ингибиторы), замедляющие ее. Ускоряющее действие катализаторов заключается в уменьшении энергии активации. Различают два вида катализа: гетерогенный (1) – катализатор и реагирующие вещества находятся в разных фазах, и гомогенный (2) – катализатор и вещества находятся в одной фазе:
1. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
2. 2NO + O2 → 2NO2
2NO2 + 2SO2 → 2SO2 + 2NO.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 868; Нарушение авторских прав?; Мы поможем в написании вашей работы!