
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соли. Состав солей и их названия. Получение и химические свойства солей. Гидролиз солей
|
|
|
|
Солями называются сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков.
Соль представляет собой продукт полного или частичного замещения атомов водорода кислоты металлом. Отсюда различают следующие группы солей:
1. Средние соли – все атомы водорода в кислоте замещены на металл.
2. Кислые соли – не все атомы водорода в кислоте замещены на металл. Разумеется, кислые соли могут образовывать только двухосновные или трехосновные кислоты.
3. Двойные соли – атомы водорода кислоты замещены не одним, а несколькими металлами.
4. Основные соли – продукт неполного или частичного замещения гидроксильных групп оснований кислотными остатками.
5. Смешанные соли – в них содержится один катион и два разных аниона.
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Соли бескислородных кислот, кроме того, могут быть получены при непосредственном взаимодействии металла с неметаллом.
Химические свойства:
1. 2NaCl + H2SO4 → Na2SO4 + 2HCl
2. Ba(OH)2 + CuSO4 → BaSO4 + Cu(OH)2
3. NaCl + AgNO3 → AgCl + NaNO3
4. Fe + CuSO4 → FeSO4 + Cu
Обменная реакция между водой и соединением называется его гидролизом. Гидролиз солей представляет собой реакцию, обратную реакции нейтрализации слабых кислот (оснований) сильными основаниями (кислотами) или слабых кислот слабыми основаниями. Гидролизу по аниону подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты. Создается щелочная среда.
Na2SO3 → 2Na+ + SO32-
Na+ + HOH → реакция не идет
SO32- + HOH ↔ HSO3- + OH-
HSO3- + HOH ↔ H2SO3 + OH-
Na2SO3 + HOH ↔ NaHSO3 + NaOH
NaHSO3 + HOH ↔ H2SO3 + NaOH
Гидролизу по катиону подвергаются соли, образованные катионом слабого основания и анионом сильной кислоты. Создается кислая среда.
CuCl2 → Cu2+ + 2Cl-
Cl- + HOH → реакция не идет
Cu2+ + HOH ↔ CuOH+ + H+
CuCl2 + HOH ↔ CuOHCl + HCl
Гидролизом по второй ступени при обычных условиях можно пренебречь.
Гидролизу по катиону и аниону подвергаются соли, образованные катионом слабого основания и анионом слабой кислоты. Реакция среды зависит от соотношения констант диссоциации образующихся кислот и оснований.
CuF2 → Cu2+ + 2F-
Cu2+ + HOH ↔ CuOH+ + H+
F- + HOH ↔ HF + OH-
Cu2+ + F- + HOH ↔ CuOH+ + HF
CuF2 + HOH ↔ CuOHF + HF
Гидролиз в данном случае протекает довольно интенсивно. Если кислота и основание, образующие соль, не только являются слабыми электролитами, но и малорастворимы или неустойчивы и разлагаются с образованием газообразных продуктов, гидролиз таких солей в ряде случаев протекает практически необратимо:
Al2S3 + 6H2O → 2Al(OH)3↓+ 3H2S↑
Количественно гидролиз соли характеризуется степенью гидролиза:
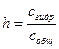
Для гидролиза по аниону в общем виде А– + НОН ↔ НА + ОН– , согласно закону действующих масс, приближенно справедливо
 .
.
Используя соотношение  , получаем
, получаем
 .
.
Для гидролиза по катиону К+ + НОН ↔ КОН + Н+ аналогично
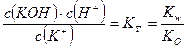 .
.
Для гидролиза по катиону и аниону К+ + А– + НОН ↔ КОН + НА
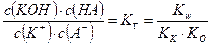
В соответствии с принципом Ле Шателье гидролиз по катиону (аниону) усиливается при добавлении к раствору соли основания (кислоты).
Взаимосвязь между различными классами неорганических соединений.
 |  |

 |
1. Металл ® соль:
2Na + Cl2 → 2NaCl (t);
2. Соль ® металл:
NiSO4 + 2H2O → Ni + O2 + H2 + H2SO4 (электролиз);
2AgNO3 → 2Ag + 2NO2 + O2 (t);
3. Неметалл ® соль:
2Na + Cl2 → 2NaCl (t);
4. Соль ® неметалл:
SiCl4 + 2Zn → Si + 2ZnCl2;
5. Металл ® оксид металла:
2Mg + O2 → 2MgO;
6. Оксид металла ® металл:
2Fe2O3 + 3C → 4Fe + 3CO2 (t);
7. Неметалл ® оксид неметалла:
4Р + 5О2 → 2Р2О5;
8. Оксид неметалла ® неметалл:
SiO2 + 2Mg → Si + 2MgO (t);
9. Оксид металла ® соль:
CuO + 2HCl → CuCl2 + H2O;
10. Соль ® оксид металла:
СаСО3 → СаО + СО2 (t);
11. Оксид неметалла® соль:
СО2 + 2NaOH → Na2CO3 + H2O;
12. Соль ® оксид неметалла:
СаСО3 → СаО + СО2 (t);
13. Оксид металла ® основание:
CaO + H2O → Ca(OH)2;
14. Основание ® оксид металла:
Cu(OH)2 → CuO + H2O (t);
15. Оксид неметалла ® кислота:
SO3 + H2O → H2SO4;
16. Кислота ® оксид неметалла:
H2SO3 → SO2 + H2O (t);
17. Основание ® соль:
NaOH + HCl → NaCl + H2O;
18. Соль ® основание:
СuSO4 + NaOH → Cu(OH)2 + Na2SO4;
19. Соль ® кислота:
NaCl + H2SO4 → HCl + NaHSO4 (t);
20. Кислота ® соль:
NaOH + HCl → NaCl + H2O.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1448; Нарушение авторских прав?; Мы поможем в написании вашей работы!