
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основания. Щелочи и нерастворимые основания. Способы получения и химические свойства
|
|
|
|
Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. Химические свойства кислот, оснований и солей в свете теории электролитической диссоциации. Реакции ионного обмена и условия их необратимости.
Взаимодействие с растворителем растворенного вещества может вызвать распад последнего на ионы. Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссоциацией или ионизацией веществ в растворах.
Возможность и степень распада растворенного вещества на ионы определяется природой растворенного вещества и растворителя. Электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярным типом связи в полярных растворителях. Вода относится к наиболее сильноионизирующим растворителям.
Вещества, распадающиеся в растворах или расплавах на положительно заряженные (катионы) и отрицательно заряженные (анионы) ионы, называются электролитами. Электролитами являются кислоты, основания, соли.
Ионы в растворе сольватированы (гидратированы), т.е. окружены оболочкой из молекул растворителя. Катионы К связаны с молекулами воды гидратной оболочки донорно-акцепторной связью и являются акцепторами электронных пар; доноры – атомы кислорода Н2О.
Анионы А – связаны с молекулами Н2О либо кулоновскими силами, либо водородной связью, при образовании которой они – доноры электронных пар. Схематически гидратную оболочку ионов можно изобразить следующим образом:


Обычно пользуются упрощенными уравнениями электролитической диссоциации, в которых гидратная оболочка ионов не указывается.
По степени диссоциации α в растворах электролиты подразделяют на сильные и слабые:
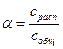
Степень диссоциации выражают в долях единицы или процентах. Электролиты, у которых α<1, относятся к слабым, у сильных электролитов α = 1.
К сильным электролитам в водных растворах принадлежат почти все соли, многие неорганические кислоты, гидроксиды щелочных и щелочноземельных металлов.
Сильные электролиты в водных растворах распадаются на ионы полностью. Их истинная степень диссоциации не зависит от концентрации раствора.
Диссоциация слабых электролитов - обратимый процесс. Для диссоциации слабого бинарного электролита КА

на основании ЗДМ справедливо соотношение:

Константу равновесие К в данном случае называют константой ионизации.
Согласно закону разбавления Оствальда, константа диссоциации бинарного электролита связана со степенью диссоциации соотношением:
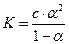
Это уравнение выражает зависимость степени диссоциации от концентрации раствора. Если α<<1, то
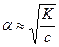
Иными словами, закон Оствальда гласит: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается. В соответствии с принципом Ле-Шателье введение в раствор слабого электролита одноименных ионов уменьшает степень его диссоциации. При уменьшении концентрации одного из ионов диссоциация слабого электролита усиливается.
Вода является очень слабым амфотерным электролитом: К = 1,8·10-16. В воде и разбавленных водных растворах электролитов значения концентрации и активности практически совпадают, а с(Н2О) практически постоянна. Поэтому можно считать постоянным ионное произведение воды (произведение концентраций водородных ионов и гидроксид-ионов при данной температуре для воды и разбавленных водных растворов) KW(KH2O): KW = K∙c(H2O) = c(H+)∙c(OH-). При 25°С Kw = 10ˉ14 моль² /л². При увеличении температуры Kw значительно возрастает. В любом растворе одновременно присутствуют Н+ и ОН– ионы. Кислотность и щелочность среды обычно характеризуют концентрацией водородных ионов или водородным показателем рН. Он равен десятичному логарифму концентрации водородных ионов, взятому с обратным знаком: pH = - lgc(H). Значение рН может быть больше 14 и быть отрицательным. Приближенно реакцию среды определяют с помощью специальных реактивов – индикаторов.
Оксиды. Классификация оксидов. Способы получения и свойства оксидов. Понятие об амфотерности.
Оксидами называются сложные вещества, в состав молекул которых входят атомы кислорода и какого-нибудь другого элемента.
Оксиды могут быть получены как при непосредственном взаимодействии кислорода с другим элементом, так и косвенным путем (например, при разложении солей, кислот, оснований). В обычных условиях оксиды бывают в твердом, жидком и газообразном состоянии.
В зависимости от того, будет этим другим элементом металл или неметалл, оксиды делятся на основные и кислотные.
Основными оксидами называются такие оксиды металлов, которым соответствуют гидраты, относящиеся к классу оснований.
Если в качестве второго элемента будет неметалл или металл, проявляющий высшую валентность, то такие оксиды будут кислотными. Кислотными оксидами (ангидридами кислот) называются такие оксиды, которым соответствуют гидраты, относящиеся к классу кислот.
Особую группу составляют амфотерные окисиды. Амфотерными оксидами называются оксиды, которые взаимодействуют как с кислотами, так и с основаниями, образуя соли.
H2O + ZnCl2 ← 2HCl + ZnO + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие.
Солеобразующие оксиды – оксиды, которые в результате реакций образуют соли.
CuO + 2HCl → CuCl2 + H2O;
CuO + SO3 → CuSO4
Несолеобразующие оксиды солей не образуют!
Элементы, обладающие постоянной СО, образуют оксиды одной из перечисленных групп. Элементы, проявляющие переменную СО могут образовывать различные оксиды. Как правило, в низшей степени окисления элемент образует основный оксид, в переходной СО – амфотерный, в высшей – кислотный.
| Основные 1. Na2O + H2O → 2NaOH 2. Na2O + SO3 → Na2SO4 3. CuO + H2SO4 → CuSO4 + H2O | Кислотные 1. SO3 + H2O → H2SO4 2. CO2 + CaO → CaCO3 3. CO2 + Ba(OH)2 → BaCO2 + H2O |
Основаниями называются сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп.
Число гидроксильных групп в молекуле основания зависит от степени скисления металла и равно ее абсолютной величине.
Все основания – твердые вещества, имеющие различную окраску. Основания щелочных и щелочноземельных металлов хорошо растворимы в воде и называются щелочами. Остальные основания плохо растворяются в воде.
Химические свойства оснований обусловливаются отношением их к кислотам, ангидридам кислот и солям.
1. CO2 + Ba(OH)2 → BaCO3 + H2O
2. 2KOH + H2SO4 → K2SO4 + 2H2O
Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, т.к. после ее окончания среда должна стать нейтральной.
3. 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4.
Кислоты. Классификация кислот. Способы получения и общие химические свойства.
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на металл.
По числу атомов водорода, способных к отщеплению в водном растворе, кислоты делят на одноосновные, двухосновные и трехосновные.
По составу кислоты делятся на бескислородные и кислородсодержащие.
Получение кислот:
1. Бескислородные кислоты могут быть получены при непосредственном взаимодействии неметалла с водородом:
H2 + S → H2S
2. Кислородсодержащие кислоты нередко могут быть получены при растворении кислотных оксидов в воде:
SO3 + H2O → H2SO4
3. Как бескислородные, так и кислородсодержащие кислоты можно получить по реакции обмена между солями и другими кислотами:
BaBr2 + H2SO4 → BaSO4 + 2HBr
CuSO4 + H2S → H2SO4 + CuS
4. В некоторых случаях для получения кислот могут быть использованы ОВ процессы:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO
Химические свойства кислот обусловлены отношением их к основаниям, металлам, солям и основным оксидам.
1. CuO + H2SO4 → CuSO4 + H2O
2. 2KOH + H2SO4 → K2SO4 + 2H2O
3. Zn + 2HCl → ZnCl2 + H2
4. CuCl2 + H2SO4 → CuSO4 + 2HCl
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1134; Нарушение авторских прав?; Мы поможем в написании вашей работы!