
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 7. Растворы электролитов
|
|
|
|
7-1. Электролиты – это вещества, растворы которых б) проводят электрический ток
7-2. Неэлектролиты – это вещества, растворы которых а) не проводят электрический ток
7-3. Электролитами являются г) основания е) кислоты ж) соли
7-4. Уравнение процесса электролитической диссоциации: а) АВ D А+ + В–
7-5. Значение ионного произведения воды д) 1×10–14
7-6. рН раствора вычисляется по формуле в) 
7-7. Электролиты классифицируют на сильные и слабые по величине а) 
7-8. рН щелочного раствора: в) рН > 7
7-9. Степенью электролитической диссоциации называется в) отношение числа распавшихся на ионы молекул к числу молекул электролита в растворе
7-10. Величина степени электролитической диссоциации зависит от а) температуры б) природы растворителя г) концентрации раствора
7-11. Уравнения, описывающие свойства растворов, для электролитов и неэлектролитов различны, потому что электролиты в) распадаются на ионы и увеличивают число частиц в растворе
7-12. Гидролизу подвергаются соли, образованные а) катионом слабого основания и анионом слабой кислоты б) катионом слабого основания и анионом сильной кислоты
г) катионом сильного основания и анионом слабой кислоты
7-13. Степень гидролиза усиливается при б) добавлении воды
7-14. Слабые электролиты имеют величину степени диссоциации а) 3% ³ a
7-15. Электролиты, при диссоциации которых из катионов образуются только катионы водорода и кислотные остатки, называются г) кислотами
7-16. Электролиты, при диссоциации которых из анионов образуются только анионы OH– и катионы металла, называются а) кислотами б) кислотными оксидами в) основаниямиг) основными оксидами д) солями
7-17. Электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка, называются б) солями
7-18. Закон разбавления Оствальда имеет вид  , где С – концентрация в) растворенного вещества
, где С – концентрация в) растворенного вещества
7-19. Ионным произведением воды (КВ) называется в) произведение константы диссоциации воды на ее молярную концентрацию
7-20. Соответствие между степенью диссоциации веществ и силой электролита:
| 1) | Na2SO4 ( = 90%) = 90%)
| а) | сильный |
| 2) | H2SO3 ( = 25%) = 25%)
| б) | средний |
| 3) | CH3COOH ( = 2, 5%) = 2, 5%)
| в) | слабый |
| 4) | C12H22O11 ( = 0%) = 0%)
| г) | неэлектролит |
7-21. Сильные электролиты являются а) NaOH ( = 90%)б) Na2SO4 (
= 90%)б) Na2SO4 ( = 0,9) г) KNO3 (
= 0,9) г) KNO3 ( = 90%)
= 90%)
7-22. Слабые электролиты являются в) HCN ( = 0,2%) е) H2S (
= 0,2%) е) H2S ( = 0,01%)
= 0,01%)
7-23. Уравнение для вычисления произведения растворимости сульфида серебра Ag2S: а)  или
или 
7-24. Соответствие между формулами электролитов и классом вещества:
| 1) | NaCl | а) | соль |
| 2) | Ba(OH)2 | б) | основание |
| 3) | H4P2O7 | в) | кислота |
7-25. Выражение константы диссоциации  соответствует уравнению: г) H3PO3 D 3H+ + PO33–
соответствует уравнению: г) H3PO3 D 3H+ + PO33–
7-26. Среда, образуемая водным раствором Na2CO3 : в) щелочная
7-27. Соответствие между обозначением и его физическим смыслом в формуле  .
.
| 1) | 
| а) | повышение температуры кипения раствора |
| 2) | i | б) | изотонический коэффициент |
| 3) | 
| в) | эбулиоскопическая постоянная |
| 4) | 
| г) | моляльная концентрация вещества |
7-28. Выражение 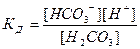 соответствует уравнению а) H2CO3 D H+ + HCO3–
соответствует уравнению а) H2CO3 D H+ + HCO3–
7-29. Среда, образуемая водным раствором Na2SO4 б) нейтральная
7-30. Изотонический коэффициент раствора NaNO3 равен 1,8. Величина степени диссоциации α при этом в) 0,8
7-31. Степень диссоциации H2SO3 составила 25%. Тогда величина изотонического коэффициента i равна б) 1,5
7-32. Изотонический коэффициент раствора CH3COOH равен 1,04. Тогда величина степени диссоциации α в) 0,04
7-33. Уравнение первой стадии гидролиза Na2CO3 в) CO32– + H2O D HCO3– + OH–.
7-34. Концентрация ионов H+ в растворе с рН =1 составляет..0,1.. моль/л
7-35. рН раствора с концентрацией ионов водорода 1 моль/л равен..0..
7-36. ПР хлорида серебра AgCl равно..., если его растворимость составляет 1,07×10–5 моль/л в) 1,14×10–10
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1006; Нарушение авторских прав?; Мы поможем в написании вашей работы!