
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 9. Окислительно-восстановительные процессы в химии 1 страница
|
|
|
|
9-1. Степенью окисления называется в) формальный заряд атома в молекуле, вычисленный исходя из предположения, что все связи являются ионными
9-2. Окислителем называется частица (атом или ион), которая а) принимает электроны в окислительно-восстановительном процессе
9-3. Восстановителем называется частица (атом или ион), которая б) отдает электроны в окислительно-восстановительном процессе
9-4. Окислением называется процесс, в котором а) атом или ион отдает электроны
9-5. Потенциал стандартного водородного электрода в) условно принят равным 0 В
9-6. Величина электродного потенциала при стандартной температуре вычисляется по формуле а) 
9-7. Электродным потенциалом называется потенциал, установившийся б) между поверхностью металла и близлежащим слоем раствора в двойном электрическом слое
9-8. Окислительно-восстановительные реакции – это реакции, в которых а) изменяется степень окисления элементов
9-9. Окислитель в ходе окислительно-восстановительного процесса а) восстанавливается
9-10. Восстановитель в ходе окислительно-восстановительного процесса б) окисляется
9-11. Электродный потенциал возникает при погружении металла в раствор г) в двойном электрическом слое, образующемся на границе между металлом и раствором
9-12. Абсолютное значение электродного потенциала измерить а) нельзя ни при каких условиях
9-13. Стандартным электродным потенциалом металла называется потенциал, в) металла, погруженного в раствор собственной соли со стандартной концентрацией ионов металла, и измеренный относительно водородного электрода при стандартных условиях
9-14. Стандартные электродные потенциалы измеряют по отношению к б) стандартному водородному электроду
9-15. Более активными, чем водород, являются металлы, стандартный электродный потенциал  которых б) более отрицателен, чем у водорода
которых б) более отрицателен, чем у водорода
9-16. Менее активными, чем водород, являются металлы, стандартный электродный потенциал которых а) более положителен, чем у водорода
9-17. Металлы, стандартный электродный потенциал которых имеет отрицательную величину, а) могут вытеснять водород из кислот
9-18. Восстановительная активность металла г) убывает с увеличением величины его электродного потенциала
9-19. Возникновение электродного потенциала на цинке показано на рисунке
| б) | 
|
9-20. Процесс установления равновесия на медном электроде отражает уравнение г) Cu0 – 2e D Cu+2
9-21. Азот имеет степень окисления +3 в соединении в) HNO2
9-22. Азот имеет степень окисления 0 в соединении б) N2
9-23. Азот имеет степень окисления –3 в соединении а) NH3
9-24. Азот имеет степень окисления +5 в соединении г) HNO3
9-25. Сера имеет степень окисления –2 в соединении а) H2S
9-26. Азот N2 в реакции N2 + 3H2 " 2NH3 является а) окислителем
9-27. Водород H2 в реакции N2 + 3H2 " 2NH3 является б) восстановителем
9-28. Цинк Zn в реакции Zn + 2HCl " ZnCl2 + H2# является б) восстановителем
9-29. Окислителем в реакции Zn + 2HCl " ZnCl2 + H2# является г) H+
9-30. Величина электродного потенциала металла зависит от а) природы металла
9-31. Верно утверждение: значение электродного потенциала г) нельзя измерить ни при каких условиях
9-32. Процесс окисления в реакции Ca + S = CaS описывается уравнением а) Ca0 – 2e– " Ca+2
9-33. Процесс восстановления в реакции Ca + S = CaS описывается уравнением д) S0 + 2e " S–2
9-34. Соответствие обозначений в уравнении Нернста 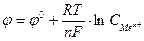 и их физического смысла
и их физического смысла
| 1) | 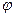
| а) | электродный потенциал |
| 2) | 
| б) | стандартный электродный потенциал |
| 3) | 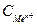
| в) | концентрация ионов металла |
| 4) | 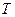
| г) | абсолютная температура |
| 5) | 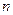
| д) | число электронов, участвующих в равновесном процесс |
9-35. Наиболее сильными восстановительными свойствами обладает а) марганец ( )
)
9-36. Наиболее слабыми восстановительными свойствами обладает г) медь (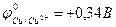 )
)
9-37. Будет вытеснять водород из кислот а) свинец (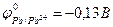 )
)
9-38. Потенциал водородного электрода равен нулю при температуре в) 298 К
9-39. Наиболее слабыми восстановительными свойствами обладает г) свинец (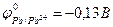 )
)
9-40. Наиболее сильными восстановительными свойствами обладает а) цинк  )
)
9-41. Потенциал водородного электрода равен 0 В при концентрации ионов водорода а) 1
9-42. Восстановительные свойства металлов усиливаются в ряду а) 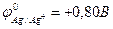
9-43. Потенциал серебряного электрода при стандартной температуре и концентрации ионов Ag+ в растворе 0,1 моль/л, (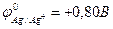 )а) 0,741 В
)а) 0,741 В
9-44. Потенциал железного электрода, погруженного в раствор соли двухвалентного железа с концентрацией ионов железа 0,01 моль/л, при стандартной температуре, ( ).а) –0,499 В
).а) –0,499 В
9-45. Восстанавливать кадмий из водных растворов солей НЕ будут ( ) а) железо (
) а) железо ( ) г) хром (
) г) хром (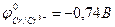 )
)
9-46. Металлическая медь будет в водных раствора вытеснять металл из солей, (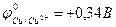 ,
, 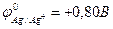 ,
,  ,
,  ,
,  )
)
9-46. Металлическая медь будет в водных раствора вытеснять металл из солей, (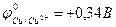 ,
, 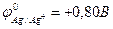 ,
,  ,
,  ,
,  ) г) нитрат серебра
) г) нитрат серебра
9-47. Потенциал водородного электрода в растворе HCl с концентрацией 1×10–4 моль/л при стандартной температуре в) –0,236 В
9-48. Электродвижущая сила гальванического элемента вычисляется по формуле б) 
9-49. Гальваническим элементом называется устройство для б) превращения энергии окислительно-восстановительных реакций в электрическую энергию
9-50. Гальванический элемент является источником тока а) первичным
9-51. Аккумулятор является источником тока б) вторичным
9-52. Анод гальванического элемента б) заряжен отрицательно
9-53. Катод гальванического элемента а) заряжен положительно
9-54. В гальваническом элементе катод и анод погружены в раствор в) электролита
9-55. Катодом в гальваническом элементе является металл с б) более положительным потенциалом
9-56. Анодом в гальваническом элементе является металл с а) более отрицательным потенциалом
9-57. Электродвижущая сила гальванического элемента равна разности а) электродных потенциалов катода и анода
9-58. Схема гальванического элемента начинается с записи а) анода
9-59. Анодная реакция в гальваническом элементе Даниеля – Якоби а) Zn0 – 2e = Zn2+
9-60. Токообразующая реакция в гальваническом элементе Даниеля – Якоби б) Cu2+ + 2e = Cu0
9-61. Значения стандартного электродного потенциала  измеряются относительно...электрода б) водородного
измеряются относительно...электрода б) водородного
9-62. Процесс... протекает на аноде гальванического элемента а) окисления
а) окисления
9-63. Процесс... протекает на катоде гальванического элемента б) восстановления
9-64. Условие работы гальванического элемента: в) 
9-65. Анодом в гальваническом элементе с железным катодом ( ) будут б) алюминий (
) будут б) алюминий (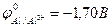 )
)
9-66. Никель ( ) будет катодом гальванического элемента в паре с а) кадмием (
) будет катодом гальванического элемента в паре с а) кадмием ( )
)
9-67. Катодная реакция в гальваническом элементе Ni |Ni2+ || Pb2+ |Pb ( ,
, 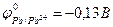 ): г) Pb2+ + 2e = Pb0
): г) Pb2+ + 2e = Pb0
9-68. Соответствие между словами и схемами
| 1) | никель – анод | а) | Ni | Ni2+ || Cu2+ | Cu |
| 2) | никель – катод | б) | Fe | Fe2+ || Ni2+ | Ni |
| 3) | свинец – анод | в) | Pb | Pb2+ || Ag+ | Ag |
| 4) | свинец – катод | г) | Zn | Zn2+ || Pb2+ | Pb |
9-69. Соответствие между токообразующими реакциями в гальваническом элементе и схемами элементов
| 1) | Zn0 + Cu2+ " Zn2+ + Cu0 | а) | Zn | Zn2+ || Cu2+ | Cu | |
| 2) | Zn0 + Fe2+ " Zn2+ + Fe0 | б) | Zn | Zn2+ || Fe2+ | Fe | |
| 3) | Ni0 + Cu2+ " Ni2+ + Cu0 | в) | Ni | Ni2+ || Cu2+ | Cu | |
| 4) | Zn0 + Ni2+ " Zn2+ + Ni0 | г) | Zn | Zn2+ || Ni2+ | Ni |
9-70. Олово Sn (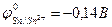 ) является катодом гальванического элемента в паре с в) никелем (
) является катодом гальванического элемента в паре с в) никелем ( ) д) цинком (
) д) цинком ( )
)
9-71. В кислотном аккумуляторе электроды в) свинцовые, кислота серная
9-72. Никель будет анодом в гальваническом элементе ( ,
, 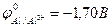 ,
, 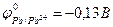 ,
, 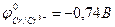 ,
,  ). б) Ni |Ni2+ || Pb2+ |Pb
). б) Ni |Ni2+ || Pb2+ |Pb
9-73. Олово будет катодом в гальваническом элементе (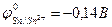 ,
, 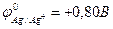 ,
, 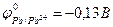 ?
?  ,
,  ). а) Sn | Sn2+ | |Ag+ | Ag в) Sn | Sn2+|| Ni2+ | Ni
). а) Sn | Sn2+ | |Ag+ | Ag в) Sn | Sn2+|| Ni2+ | Ni
9-74. Записана правильно схема гальванического элемента
( ,
, 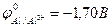 ,
, 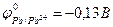 ,
, 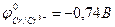 ,
,  ).
).
б) Ni |Ni2+ || Pb2+ |Pb
9-75. Электроды в схеме гальванического элемента … обозначены правильно б) –A) Fe | Fe2+ || Cu2+ | Cu (K+
9-76. Процесс Ni0 – 2e " Ni2+ протекает на аноде в гальванических элементах.... ( ,
, 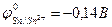 ,
,  ,
, 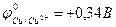 ).в) Ni | Ni2+ || Cu2+ | Cu0 г) Ni | Ni2+ || Sn2+ | Sn0
).в) Ni | Ni2+ || Cu2+ | Cu0 г) Ni | Ni2+ || Sn2+ | Sn0
9-77. Железо окисляется в гальваническом элементе... ( ,
,  ,
, 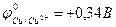 ,
,  ,
, 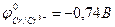 ). б) Fe | Fe2+ || Cu2+ | Cu
). б) Fe | Fe2+ || Cu2+ | Cu
9-78. Электродвижущая сила гальванического элемента, составленного из цинка и ртути ( ,
,  ) равна г) 1,61 В
) равна г) 1,61 В
9-79. ЭДС (электродвижущая сила) гальванического элемента Ni | Ni2+ || Cu2+ | Cu ( ,
, 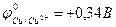 ) равна а) 0,59 В
) равна а) 0,59 В
9-80. ЭДС (электродвижущая сила) гальванического элемента Fe | Fe2+ || Cu2+ | Cu в сравнении с ЭДС элемента Fe | Fe2+ || Ni2+ | Ni
( ,
, 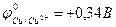 ,
,  ): а) больше
): а) больше
а) больше
9-81. ЭДС (электродвижущая сила) гальванического элемента Fe | Fe2+ || Cu2+ | Cu в сравнении с ЭДС элемента Fe | Fe2+ || Ag+ | Ag
( ,
, 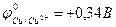 ,
, 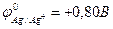 ) б) меньше
) б) меньше
9-82. ЭДС гальванического элемента при изменении концентрации растворов, в которые погружены катод и анод, в одинаковое число раз в) не изменится
9-83. ЭДС (электродвижущая сила) гальванического элемента Zn | Zn2+ || Cu2+ | Cu равна ( ,
, 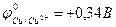 ) а) 1,1 В
) а) 1,1 В
9-84. Наибольшая электродвижущая сила у гальванического элемента ( ,
,  ,
, 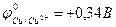 ,
,  ,
,  ) в) Zn | Zn2+|| Cu2+ | Cu
) в) Zn | Zn2+|| Cu2+ | Cu
9-85. Соответствие между схемой гальванического элемента и величиной электродвижущей силы. (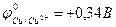 ,
,  ,
,  ,
,  ,
, 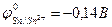 ).
).
| 1) | Cu | Cu2+ || Ni2+| Ni | а) | 0,59 В |
| 2) | Cu | Cu2+ || Hg2+| Hg | б) | 0,51 В |
| 3) | Cu | Cu2+ || Cd2+| Cd | в) | 0,74 В |
| 4) | Cu | Cu2+ || Sn2+| Sn | г) | 0,48 В |
9-86. Скорость электрохимической коррозии рассчитывается по формуле а) 
9-87. Глубинный показатель коррозии рассчитывается по формуле: б) 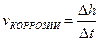
9-88. Фактор рыхлости при коррозии металлов рассчитывается по формуле г) 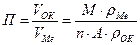
9-89. Массовый показатель коррозии рассчитывается по формуле г) 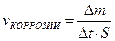
9-90. Местная коррозия показана на рисунке
| б) | 
|
9-91. Сплошная коррозия показана на рисунке
| а) | 
|
9-92. Условием возможности протекания коррозии является в) 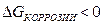
9-93. Процесс самопроизвольного разрушения металла при взаимодействии с окислителем возможен
9-94. Первичный процесс коррозии железа в чистом влажном воздухе описывается уравнением б) 2Fe + O2 + 2H2O = 2Fe(OH)2
9-95. Коррозией называется процесс б) самопроизвольного разрушения металла, происходящего при взаимодействия с окружающей средой
9-96. Процесс коррозии представляет собой самопроизвольную реакцию... происходящую при взаимодействии с веществами, находящимися в окружающей среде а) окисления металла
9-97. Коррозия по механизму протекания бывает а) химическая б) электрохимическая
9-98. Химическая коррозия протекает а) в газовой среде в отсутствии влаги
9-99. Процессы окисления металла и восстановления окислителя при химической коррозии протекают... на поверхности металла а) одновременно в одном месте
9-100. Процессы окисления металла и восстановления окислителя при электрохимической коррозии протекают... на поверхности металла в) в различное время в одном месте
9-101. Механизм электрохимической коррозии а) перенос электронов от металла к окислителю
9-102. Электрохимическая коррозия может протекать в следующих средах а) влажный воздух б) растворы кислот г) растворы щелочей
9-103. Катодный процесс, протекающий в чистом влажном воздухе б)O02 + 2H2O + 4e = 4OH-
9-104. Катодный процесс, протекающий в кислой среде а)2H+ + 2e = H02
9-105. Анодный процесс, протекающий в чистом влажном воздухе а) Me0 – ne = Men+
9-106. Анодный процесс, протекающий в кислой среде а) Me0 – ne = Men+
9-107. Первичными продуктами электрохимической атмосферной коррозии металла во влажном воздухе являются б) гидроксиды металлов
9-108. Первичными продуктами электрохимической коррозии металла в кислой среде являются в) соли металлов
9-109. Реакция... протекает на катодных участках при электрохимической коррозии с водородной деполяризацией а) 2H+ + 2e = H02 б) 2H2O + 2e = H02 + 2OH –
9-110. Анодным называется покрытие а) более активным металлом
9-111. Катодным называется покрытие б) менее активным металлом
9-112. Анодное покрытие является более эффективным при защите от коррозии, потому что б) разрушается само при повреждении поверхности
9-113. Катодное покрытие является менее эффективным при защите от коррозии, потому что в) способствует разрушению металла, находящегося под покрытием, при нарушении поверхности
9-114. Ингибиторами коррозии называются б) вещества, замедляющие процесс разрушения металла
9-115. Соответствие обозначений и их физического смысла в формуле 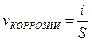 :
:
| 1) | 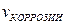
| а) | скорость коррозии |
| 2) | 
| б) | сила тока, возникающего при коррозии |
| 3) | 
| в) | площадь корродирующей поверхности |
| г) | объем продуктов коррозии |
9-116. Соответствие обозначений и их физического смысла в формуле  :
:
| 1) | 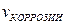
| а) | скорость коррозии |
| 2) | 
| б) | потеря массы изделия |
| 3) | 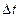
| в) | время коррозии |
| 4) | 
| г) | площадь корродирующей поверхности |
9-117. Анодным покрытием для железа (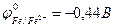 ) может служить а) цинк (
) может служить а) цинк ( )
)
9-118. Катодным покрытием для меди ( ) может служить г) серебро (
) может служить г) серебро (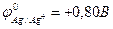 )г) серебро (
)г) серебро (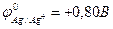 )
)
9-119. Анодным покрытием для цинка ( ) будет г) алюминий (
) будет г) алюминий ( )
)
9-120. Протекторную защиту железа (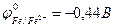 ) можно осуществить с помощью
) можно осуществить с помощью
а) цинка ( )в) алюминия (
)в) алюминия ( )
)
9-121. Катодному процессу при коррозии меди, покрытой оловом, при повреждении покрытия в сильно кислом растворе соответствует уравнение: г) 2H+ + 2e " H20
9-122. Анодному процессу при коррозии меди ( ), покрытой оловом (
), покрытой оловом (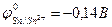 ), при повреждении покрытия в сильно кислой среде соответствует уравнение б) Sn0 – 2e = Sn2+
), при повреждении покрытия в сильно кислой среде соответствует уравнение б) Sn0 – 2e = Sn2+
9-123. Катодному процессу при коррозии оцинкованного железа во влажном воздухе при повреждении покрытия соответствует уравнение а) O2 + 2H2O + 4e = 4OH–
9-124. Анодному процессу при коррозии оцинкованного железа [  ,
, 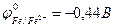 ] при повреждении покрытия соответствует уравнение в) Zn0 – 2e = Zn2+
] при повреждении покрытия соответствует уравнение в) Zn0 – 2e = Zn2+
9-125. Для протекторной защиты никеля (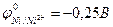 ) НЕ могут быть использованы
) НЕ могут быть использованы
б) свинец ( )г) серебро (
)г) серебро (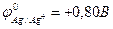 )
)
9-126. Первичный продукт коррозии оцинкованного железа [  ,
, 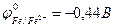 ] во влажном воздухе имеют состав
] во влажном воздухе имеют состав
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 811; Нарушение авторских прав?; Мы поможем в написании вашей работы!