
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титровані розчини в методах нейтралізації
|
|
|
|
При кислотно-основних титруваннях найчастіше використовують робочі розчини сірчаної, соляної кислот та гідроксидів натрію або калію. Ці речовини не є вихідними, тому неможливо приготувати їх розчини з точною молярною концентрацією еквівалентів. Тому спочатку готують розчини цих речовин з концентрацією, близькою до необхідної. Розчини лугів готують розчиненням приблизної маси речовини в необхідному об'ємі води, розчини сірчаної та соляної кислот - розведенням водою розрахованих об'ємів більш концентрованих розчинів кислот. Точні молярні концентра-
ції еквівалентів сірчаної та соляної кислот найчастіше встановлюють за титрованим розчином тетраборату натрію Na2B4O7'10H2O (вихідна речовина), а молярну концентрацію еквівалента розчинів гідроксиду натрію або гідроксиду калію визначають за титрованими розчинами сірчаної чи соляної кислот.
Перманганатометрія.
Окиснення відновників розчином перманганату калію.
Стандартний розчин – розчин перманганату калію, точна концентрація якого встановлюється за допомогою оксалату натрію. Найчастіше застосовується стандартний розчин C/1/5 КмпО4/=0,05 моль/л.
Перманганат калію застосовують для визначення багатьох неорганічних і органічних речовин. В кислих розчинах він відновлюється до йонів двовалентного мангану:
Mno-4+8H++5eÛ Mn2++4H2O Eo=1,51 B
В слабокислих, нейтральних і слабо лужних розчинах відновлення відбувається до оксиду мангалу (ІУ):
MnO-4+2H2O+3e=MnO2+4OH- Eo=0,6 B
В сильно лужних розчинах реакція проходить з утворенням манганат-йонів.
MnO-4+e=MnO2-4 Eo=0,56 B
Найчастіше застосовують титрування КMпО4 в кислому середовищі, поскільки окисно-відновний потенціал пари
Eo MnO-4/Mn2+=+1,51 B виший ніж E MnO-4/MnO2=+0,6 B. Крім того, в кислому середовищі йони MnO-4 забарвленні в червоно-фіолетовий колір, а відновлені катіони Mn2+ безбарвні. В цьому випадку КMпО4 є одночасно і індикатором реакції, бо за зміною власного забарвлення дозволяє встановити точку еквівалентності реакції.
Застосовують прямі і непрямі методи титрування.
Прямим титруванням визначають відновники, коли реакція протікає в кислому розчині при безпосередній взаємодії КMпО4 з відновником. Таким методом визначають багато неорганічних йонів в нижчих або середніх ступенях окислення, наприклад, йони: Fe2+, As3+, Sb3+, Sn2+, H2O2, VO2, Mo5+, U4+, Ti3+ і ін.
Метод оберненого титрування полягає в наступному: до досліджуваного розчину відновника доливають точно відміряний об’єм стандартного розчину відновника (взятого в надлишку), який здатний взаємодіяти з відновником і перманганатом калію. Проходить реакція взаємодії визначуваних йонів з відновником. Надлишок відновника титрують стандартним розчином перманганату калію. Знаючи всі кількості реагентів, за різницею визначають кількість окисника.
Методом зворотнього титрування визначають вміст йонів, які утворюють з відновником малорозчинні сполуки. Так можна визначити йони Ca2+, Sr2+, Ba2+, Zn2+, Co2+, La3+, Th4+, Ce3+, Ag+, Pb2+ і ін.
Багато органічних речовин окисляються перманганатом, наприклад, аліфатичні і ароматичні кислоти, оксикислоти, феноли і ін. Цей спосіб застосовують для визначення окиснюваності води і використовується для аналізу стічних вод.
Для встановлення кислого середовища при титруванні застосовують тільки розчин сульфатної кислоти.
Застосувати HNO3 не можна, бо HNO3 теж сильний окисник і буде взаємодіяти з визначуваним відновником (результати будуть неточні).
Розчин HCl не використовують, тому що HCl може окислюватися розчином КMпО4 до Cl2. КМпО4 буде витрачатись не за призначенням і результати аналізу будуть неточні.
Комплексонометрія
Комплексонометрія – це титриметричний метод аналізу, який застосовується на використанні реакцій йонів металів комплексоутворювачів з комплексонами, що супроводжується утворенням стійких малодисоційованих розчинних внутрікомплексних (клешневих) солей.
Стандартний розчин – розчин двонатрієвої солі етилендиамінтетраоцтової кислоти (ЕДТА), або інакше його називають комплексом Ш або трилон Б:

(скорочено Na2H2У)
ЕДТА утворює з багатьма катіонами металів стійкі, малодисоційовані, розчинні в воді внутрішньо комплексні солі, за рахунок здатності карбоксильних груп утворювати солі металів, підсилені ефектом виникнення координаційного (донорно-акцепторного) зв’язку між катіоном і вільною парою електронів атому азоту:

Утворені сполуки досить стійкі, відрізняються досить малими константами нестійкості комплексних йонів.
Кнест.Ca+2»10-10, Кнест.Zn2+»10-16.
Індикатори. Як індикатори при комплексонометричних титруваннях застосовують органічні барвники: кислотний хром темно-синій, кислотний хромоген чорний спеціальний (інакше називається еріохром чорний Т або хромоген спеціальний ЕТ ОО), мурексид, ксиленоловий оранжевий і ін. Їх ще називають метало-індикаторами.
Ці індикатори утворюють з йонами кальцію, магнію і іншими атомами забарвлені внутрішньокомплексні сполуки. Ці комплексні сполуки менш стійкі, ніж комплекси з ЕДТА, а тому можуть розкладатись, переходячи до більш стійкого комплексу, утворюючи вільний індикатор, який має інший, ніж комплекс, колір.
Еріохром чорний Т – це органічний азобарвник групи о,-о/ –диоксіазонафталіну:
 (H3Ind)
(H3Ind)
Сам індикатор забарвлений у синій колір. В нейтральному або лужному середовищі (pH-7¸11) цей індикатор утворює з йонами металів (Ca+2, Mg+2, Zn+2, Mn+2, Al+3 і ін.) сполуки червоного кольору.
Мурексид (пурпурат амонію)
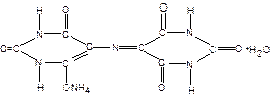
це темно-вишневий порошок. У воді має фіолетово-червоний колір, який залежить від pH середовища. З катіонами кальцію, кобальту, нікелю, міді і іншими цей індикатор утворює комплексні розчинні в воді сполуки червоного або жовтого кольору.
Фіксація точки еквівалентності відбувається при застосуванні метало-індикаторів, які утворюють з катіонами визначуваних елементів розчинні в воді забарвлені комплексні сполуки. Ці комплексні сполуки менш стійкі, ніж сполуки з комплексонами, які застосовуються як стандартний розчин. Тому в процесі титрування комплексоном розчину, що містить забарвлену метало-індикатором комплексну сполуку, в точці еквівалентності спостерігається зміна кольору.
Схематично:
Kt2+ +2HInd ®KtInd2 +2H+
без кольору забарвлений забарвлений
в інший колір
KtInd2+Na2H2У®KtNa2У +2Hind
без кольору забарвлений
Таким чином метал-індикатор реагує на зміну концентрації катіону аналогічно як кислотно-основний індикатор реагує на зміну pH-розчину.
Умови комплексонометричного титрування:
Необхідність строгого дотримання pH розчину.
В сильно кислих розчинах з pH<3 утворюється менш стійкі кислі комплексні сполуки. В сильно лужних розчинах при pH>10 утворюються комплексні оксісполуки або осади гідроксидів визначуваних катіонів.
Крім того, в процесі титрування звільняються йони водню і pH понижується, що приводить до зміни pH. Тому дуже важливо створювати умови, при яких pH не міняється. Це можна зробити за допомогою буферного розчину.
Титрування більшості катіонів проводять при pH=8¸9 в аміачному буферному розчині (NH3+NH4ОН).
Заняття №
Тема: Метод нейтралізації. Ацидиметрія. Алкаліметрія.
Актуальність теми: Методи об’ємного аналізу, зокрема методи нейтралізації, широко використовуються в біохімічних лабораторіях. Аналіз біологічних рідин дає багато корисної інформації для діагностики захворювань. Метод нейтралізації ґрунтується саме на реакціях нейтралізації, які використовуються при визначенні кислот, основ, солей, фенолів, амінів, амінокислот, різних фармацевтичних і медичних препаратів. Методом нейтралізації можна визначити важливий клінічний показник – кислотність шлункового соку.
Навчальні цілі:
Знати: принципи методу нейтралізації. Способи вираження концентрації і визначення точки еквівалентності. Застосування методу нейтралізації в медицині.
Вміти: визначати точку еквівалентності. Проводити титрування методом ацидометрії. Розраховувати концентрації досліджуваних розчинів.
Самостійна позааудиторна робота студента
1. Принцип методу нейтралізації.
2. Робочі і стандартні розчини методу нейтралізації. Способи вираження їх концентрації.
3. Криві титрування. Точка нейтралізації.
4. Індикатори методу нейтралізації.
5. Визначення моменту еквівалентності при кислотно- основному титруванні.
6. Прикладне значення методу нейтралізації в медицині.
7. Визначення кислотності шлункового соку. Одиниці вираження кислотності шлункового соку.
Контрольні питання
1. Для визначення загальної кислотності шлункового соку, 5 мл його від титрували 0,0952 еквівалентним розчином лугу, затративши для цього 2,8мл. Яка кислотність шлункового соку в клінічних одиницях?
2. Розрахувати молярну концентрацію еквівалентну соляної кислоти та титр розчину, якщо на титрування 10 мл його витратили 13,6 мл 0,151 еквівалентного розчину їдкого натру.
Самостійна робота на занятті.
Виконати лабораторні роботи.
1.Визначити молярної концентрації еквіваленту соляної кислоти за стандартним розчином бури.
2. Визначити концентрації лугу за титрованим розчином соляної кислоти.
Методика виконання лабораторної роботи
Робота1. Визначення молярної концентрації еквіваленту соляної кислоти за стандартним розчином бури.
Кожна група із 2-3 студентів готує в мірній колбі розчин тетраборату натрію (концентрацію розчину пропонує викладач). Враховуючи об’єм мірної колби, задану величину концентрації група розраховує наважку солі. Розраховану масу солі відважують на вазі, переносять в мірну колбу і водою доводять до мітки.
В колбочку для титрування відміряють піпеткою точно 5 мл виготовленого розчину тетраборату натрію, додають 1-2 каплі індикатора метил-оранжу, від чого розчин стає жовтого кольору.
В бюретку наливають досліджуваного розчину соляної кислоти (невідомої концентрації) і титрують нею розчин в колбочці до переходу забарвлення у блідо-рожеве. Титрування повторюють ще 2 рази. Дані записують у таблицю:
| № проби | Vбури мл | Ceбури | VHCl мл | Розраховано |
| Ce(HCl) | T(HCl) |
За середнім значенням V(HCl), витраченого на титрування розраховують молярну концентрацію еквівалентну соляної кислоти в розчині та титр розчину:
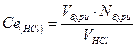

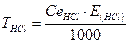
За одержаними даними зробити висновок про концентрацію кислоти в досліджуваному розчині.
Робота 2. Визначення концентрації лугу за титрованим розчином соляної кислоти.
В колбочку для титрування відміряють піпеткою 5 мл досліджуваного розчину лугу (з невідомою концентрацією), додають 1-2 каплі індикатора метил-червоного і титрують із бюретки тією ж соляною кислотою, що в роботі № 1 (концентрація її вже відома за розрахунками), до переходу забарвлення від жовтого до блідо-рожевого. Титрування повторюють ще 2 рази. Результати записують у таблицю.
| № проби | VNaOH мл | CeHCl мл | VHCl мл | Розраховано |
| CeNaOH | TNaOH |
За середнім значенням V(HCl), витраченого на титрування і Ce(HCl) розраховують молярну концентрацію еквівалентну лугу в розчині та титр розчину:
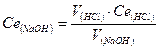
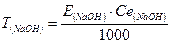

За одержаними даними зробити висновок про концентрацію лугу вдосліджуваниму розчині.
ЗАНЯТТЯ №
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1364; Нарушение авторских прав?; Мы поможем в написании вашей работы!