
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні питання теми
|
|
|
|
Тема: Дослідження фізико-хімічних властивостей питної води. Твердість води.
Мета: Закріпити знання методів об'ємного аналізу і оволодіти напикамн науково-дослідної роботи.
Науково-дослідна робота студентів /НДРС/
Природні води являються розчинами, різними за складом з широким діапазоном вмісту розчинених речовин. Формування складу природних вод проходить в результаті вилужнення, випаровування, конденсації і іонного обміну, поглинання і виділення газів, життєдіяльності організмів і в результаті інших фізико-хімічних процесів взаємодії вод з породами, грунтами, газами та забруднювачами навколишнього середовища. Для санітарної оцінки чистоти питної води має важливе значення визначення ступеня забрудненості її залежно від розчинених органічних речовин тваринного і рослинного походження, кількості розчинених солей азотистої кислоти, вмісту заліза, солей кальцію та магнію.
1. Які методи об'ємного аналізу Ви знаєте?
2. Робочі і стандартні розчини об'ємних методів аналізу, їх виготовлення, встановлення титру і зберігання.
3. Які реакції лежать в основі об'ємних методів аналізу:
а/ нейтралізації
б/ йодометрії
в/ перманганатометрії
г/ комплексонометрії.
4. Що таке комплексони?
5. Яким методом ведуть визначення загальної твердості води, яка реакція лежить в основі цього методу?
6. Яким методом ведуть визначення тимчасової твердості води, яка реакція лежить в основі цього методу?
7. Мінералізація води. Класифікація вод за ступенем мінералізації.
8. Питна вода: основні фізико-хімічні показники.
9. ІЦо характеризує поняття "окислюваність води". Границі даного показника для питної води.
10. Значення фізико-хімічних досліджень питної води.
Самостійна робота на занятті
Контрольні дослідження природних вод за методами об'ємного аналізу включають:
а/ метод централізації
б/ метод перманганатометрії
в/ метод комплексонометрії.
Заняття є проміжним заліковим по набутих практичних навиках з об'ємних методів аналізу.
На заняття кожна група із 2-3 студентів приносить на дослідження 0,5 л
води, відібраної із колодязів, природних джерел, відкритих водоймищ,
/не слід приносити воду із міської мережі/.
Робота 1. Визначення тимчасової твердості води.
Тимчасову твердість води, яка характеризується присутністю в ній
гідрокарбонатів кальцію і магнію, визначають методом нейтралізації.
В колбочку для титрування вносять 50 мл досліджуваної води. додають
2 краплі індикатора метил-оранжу і титрують із бюретки 0,1 е розчином
НС1 до зміни забарвлення від жовтого до рожевого.
Титрування повторюють 3 рази. Результати заносять у таблицю №1:
| №п/п | VH2O | VHCl | СНС1 | Ттимч., мг-екв/л |
Обчислення тимчасової твердості досліджуваної води / в мг-екв/л / ведуть за формулою:

Робота 2. Визначення загальної твердості води.
Загальну твердість води, яка характеризується сумарним вмістом
розчинених солей кальцію і магнію не залежно під природи аніону,
визначають комплексонометрично.
В колбочку для титрування вносять 5 мл досліджуваної води, 1 мл
амонійного буферу, 2-3 краплі індикатора хромогену чорного і титрують
0,01 е розчином трилону Б до зміни забарвлення від червоно-фіолетового
до зеленувато-синього. Титрування повторяють 3 рази. Результати
заносять у таблицю №2:.'ґ
| № п/п | V H2O | V тр.Б | С тр.Б | ТЗАГ. мг-екв/л |
Обчислення загальної твердості досліджуваної води / в мг-екв/л / ведуть за формулою:

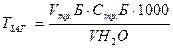
Робота 3. Визначення постійної твердості води.
Постійну твердість води, яка обумовлена присутністю в ній солей СаСІ2, МgС12 СаS04, МgS04, визначають розрахунково, як різницю між загальною і тимчасовою твердістю:
ТПОСТ.=ТЗАГ.-ТТИМЧ.
Робота 4. Визначення окислюваності води.
Окислювачість - величина яка характеризує загальну кількість у воді відновиників як органічних так і неорганічних, зокрема, нітритів. сульфітів, гумінових кислот. Н2S, солей Fе /II/ і ін. Визначення вмісту зазначених речовин грунтується на їх схильності окислюватися перманганатом калію.
В колбочку для титрування вносять 10 мл досліджуваної води, додають 1 мл 1 е розчину Н2SO4 і титрують із бюретки 0,02 е розчином КмnО4, до слабо-рожевого забарвлення. Доливають ще 1 мл КмnО4, і суміш перемішують на протязі 5-10 хв. Потім в колбочку додають 1 мл титрованого розчину щавелевої кислоти, внаслідок чого вміст колбочки знебарвлюється. Знебарвлений розчин продовжують титрувати перманганатом до появи рожевого кольору. Фіксують загальний об'єм використаного розчину КмnО4, за яким розраховують окислюваність /X/ за формулою:

Робота 5. Визначення вмісту заліза у воді.
Загальний зміст заліза у воді визначають комплексонометрично, для чого попередньо іони Fe /II/ окислюють в іони Fе /III/ за допомогою персульфату амонію. Іон Fе /III/ утворює з трилоном Б, на відміну під інших катіонів, найстійкіший комплекс.
В колбочку для титрування вносять 20 мл досліджуваної води, 5 мл ацетатного буфера. 2-3 краплі індикатора /сульфосаліцилової кислоти/, декілька кристаликів персульфату амонію і титрують 0.01 е розчином трилону Б до зміни забарвлення від фіолетового до світло-жовтого. Користуючись формулою, за об'ємом -грилону Б, затраченого на титрування розраховують вміст заліза у досліджуваній воді / г/л
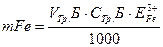
При розрахунках еквівалент іона Fе3+ необхідно брати рівним половині атомної маси заліза, в зв'язку з тим, що іон Fе3+ заміщує в аніоні трилону Б два іони водню.
Результати проведених фізико-хімічних досліджень води оформляють у вигляді звіту на окремих стандартних листках /із альбому/. Перша сторінка є титульною, де вказують: ІФДМА, кафедра, назва роботи, прізвище студента виконавця, прізвище викладача керівника групи.
Звіт повинен включати такі розділи:
1. Загальні відомості про досліджувану воду:
Місце відбору проби води /колодязь, джерело, озеро, річка чи інше водоймище/. Глибина відбору проби води. Як віддалене місце відбору води від фабрик, заводів, виробництв, тваринницьких ферм, складів міндобрив та ін. Для яких цілей використовується дана вода.
2. результати досліджень:
Зовнішній вигляд води, наявність запаху, кольору, мутності. Дані хімічного аналізу: загальна твердість, тимчасова твердість і постійна твердість; окислюваність; вміст загального заліза. Наявність таблиці результатів досліджень і розрахунки.
3.висновки.
Належно оформлений звіт подається викладачу - керівнику групи, який проводить опитування кожного студента по основних питаннях даної теми і виставляє сумарну оцінку за набуті практичні навики по об'ємних методах аналізу.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 348; Нарушение авторских прав?; Мы поможем в написании вашей работы!