
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості. Хімічні властивості лужних металів
|
|
|
|
Фізичні властивості
Хімічні властивості лужних металів.
Реферати
Модульна контрольна робота № 2
Лабораторна робота 3. Дослідне підтвердження закону Бойля – Маріотта.
Лабораторна робота 4. Визначення відносної вологості повітря.
Лабораторна робота 5. Визначення поверхневого натягу води методом відриву крапель.
1.Пояснення агрегатних станів речовини на основі МКТ.
2.Явища змочування і капілярності у природі і техніці.
3.Взаємодія атомів і молекул речовин у різних агрегатних станах.
4.Властивості парів.
5.Полімери: їх властивості та застосування.
6.Закони термодинаміки.
7.Теплові двигуни.
Список джерел інформації
1. Дмитрієва В.Ф. Фізика. Навчальний посібник для студентів вищих навчальних закладів 1-2 рівнів акредитації, 2008
2. Жданов Л.С., Жданов Г.Л. Фізика. Підручник для середніх спеціальних навчальних закладів. – К.: Высшая школа, 1983
3. Сиротюк В.Д. Фізика; підручник для 10 класів загальноосвітніх навчальних закладів (рівень стандарту), 2011
4. Кирик Л.А. Фізика 10 клас. Запитання, задачі, тести (рівень стандарту), 2010
5. Кирик Л.А. Фізика 10 клас. Різнорівневі самостійні та тематичні контрольні роботи (рівень стандарту), 2010
6.Альошина М.О. Фізика. Типові тестові завдання, 2011
7.Непорожня Л.В., Петренко А.М., Овсянніков О.А., Селезнев Ю.О Збірник завдань для державної підсумкової атестації з фізики. 11 клас – К.: Освіта, 2011
8.Гельфгат І.М. та ін. Збірник різнорівневих завдань для державної підсумкової атестації з фізики. – Харків: Гімназія, 2003. – 80 с.
9.Римкевич А.П. Збірник задач з фізики. – Харків: Олант, 2007. – 224с.
10.Дудінова О.В., Демченко К.Е. Фізика за всією шкільною програмою.- Харків: Вежа. ФОН Співак В.А., 2009. -380с.
11.Садовий А.І., Лего Ю.Г. Основи фізики з задачами і прикладами їх розв’язування. – Київ: Кондор, 2003. – 384с.
Одержують Алюміній електролізом Al2O3 у розплавленому кріоліті за температури близько 1000 0С.
Взаємодія з неметалами:
1) З киснем:
4Аl + 3О2 = 2Аl2О3
2) З галогенами:
2Аl + ЗВr2 = 2АlВr3
3) З іншими неметалами при підвищенні температури:
2Аl + 3S = Аl2S3 (сульфід алюмінію)
2Аl + N2 = 2АlN (нітрид алюмінію)
4Аl + 3С = А14С3 (карбід алюмінію)
15. -----
Залізо — блискучий сріблясто-білий важкий метал. Густина його 7,86 т/м³; температура плавлення 1538 °C, температура кипіння 2862 °C. Залізо досить пластичне. Воно легко кується, штампується, витягується в дріт і вальцюється в тонкі листи, легко намагнічується і розмагнічується. Вище температури Кюрі (770 °C) втрачаєферомагнітні властивості. До температури 912 °C існує в алотропній модифікації α-заліза з об'ємноцентрованою кубічною кристалічною ґраткою, за вищої температури — γ-заліза із гранецентрованою кубічною ґраткою, вище 1394 °C знову змінює тип ґратки на об'ємноцентровану кубічну (δ-залізо).
Ферум належить до восьмої групи періодичної системи елементів Менделєєва. Його атоми на зовнішній електронній оболонці мають по два електрони, а на передостанній — 14 електронів. Атоми феруму можуть легко втрачати два електрони і перетворюватись у двовалентні катіони Fe2+. Вони можуть втрачати і три електрони (один з передостанньої оболонки) і перетворюватись у тривалентні катіони Fe3+. Таким чином, залізо утворює два ряди сполук. Сполуки тривалентного феруму стійкіші.
У сухому повітрі за звичайної температури залізо досить стійке, але у вологому швидко іржавіє, вкриваючись товстим шаром іржі. Іржа є сумішшю оксидів і гідроксидівферуму. Основну частину іржі складає сесквіоксид заліза Fe2O3 і тригідроксид заліза Fe(OH)3. Крім того, до її складу входить монооксид заліза FeO, дигідроксид залізаFe(OH)2 та інші сполуки. Процес ржавіння заліза можна зобразити такими приблизними рівняннями:
· 2Fe + O2 + 2Н2О = 2Fe(OH)2
· 4Fe(OH)2 + O2 + 2Н2О = 4Fe(OH)3
· Fe(OH)2 = FeO + H2O
· 2Fe(OH)3 = Fe2O3 + 3H2O
17. Металічні корисні копалини- – природні мінеральні утворення, з яких доцільно вилучати метали та їх сполуки.
Найпоширенішими є руди:
· залізні,
· алюмінієві,
· манґанові,
· олов’яні,
· срібні,
· ртутні,
· титанові,
· цинкові.
Одержання металів з руд
В більшості випадків руди містять різні домішки у вигляді піску, глини, вапняку тощо. Ці домішки називають пустою породою. Коли в руді багато пустої породи, тобто коли руда є бідною на корисну речовину, таку руду піддають збагаченню, тобто видаляють з неї частину пустої породи. Різні руди збагачують різними способами.
Для збагачення сульфідних руд звичайно застосовують спосіб флотації (спливання). При цьому способі руду розмелюють у тонкий порошок і заливають у великих чанах водою. До води додають певні органічні речовини (наприклад, соснове масло, вищі жирні кислоти тощо), молекули яких добре адсорбуються частинками сульфідів, і вкривають їх тонкою плівкою, внаслідок чого вони не змочуються водою. Крізь воду продувають повітря, пухирці якого з маслом утворюють піну, а також прилипають до частинок сульфідів, і вони спливають та збираються зверху разом з піною, а змочені водою частинки пустої породи осідають на дно (див. мал. Схема флотаційного апарату). Піну з сульфідами металів зливають з чану і віджимають сульфіди. Так одержують збагачену на корисну речовину руду.
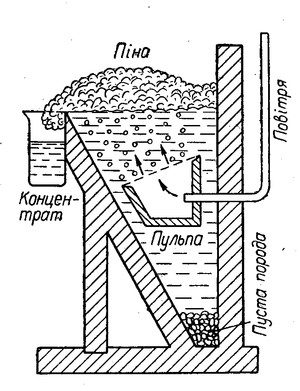

Схема флотаційного апарату
Вільні метали добувають з руд різними способами. З оксидних руд метали одержують відновленням їх за високих температур. При цьому як відновник частіше всього використовують вугілля (кокс) і монооксид вуглецю СО. Наприклад:
· Fe2O3 + 3C = 2Fe + 3CO ↑
· Fe2O3 + 3CO = 2Fe + 3CO2 ↑
· SnO2 + C = Sn + CO2 ↑
· 2Cu2O + C = 4Cu + CO2 ↑
Інколи відновником служать активні метали. Наприклад, при добуванні хрому, берилію, мангану та інших як відновник застосовують алюміній (алюмінотермія):
· Cr2O3 + 2Al = 2Cr + Al2O3
· 3MnO2 + 4Al = 3Mn + 2Al2O3
У деяких випадках як відновник використовують водень, зокрема, при добуванні молібдену, вольфраму, порошкоподібного заліза тощо:
· Fe2O3 + 3H2 = 2Fe + 3H2O
· WO3 + 3H2 = W + 3H2O
Сульфідні руди спочатку обпалюють, переводячи їх в оксиди металів, які потім відновлюють. Наприклад:
· 2PbS + 3O2 = 2PbO + 2SO2 ↑
· PbO + C = Pb + CO ↑
Найактивніші метали — калій, натрій, кальцій та інші — не можна одержати способом хімічного відновлення їх сполук. Ці метали одержують лише електролізом їх розплавлених солей. Наприклад:
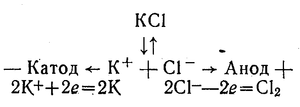
У техніці найбільшого застосування набули залізо, алюміній, мідь, свинець, цинк, олово, нікель. Вони ще мають назву «технічні метали».
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!