
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Приєднання
|
|
|
|
Арени
Аре́ни (також аромати́чні вуглево́дні) — органічні сполуки, які належать до класу карбоциклічних сполук. У складі молекулиароматичних вуглеводнів є одна або кілька груп з 6 атомів вуглецю(Карбону), сполучених у кільце (бензенове ядро) простими і подвійними зв'язками (формула Кекуле). За сучасними уявленнями, атоми Карбону в бензеновому ядрі сполученіелектронами двох типів: одні електрони містяться в площині молекули, інші розміщені перпендикулярно до неї.
Ароматичні вуглеводні відзначаються особливою здатністю до реакцій заміщення і стійкістю бензенового ядра. При замініводню в ароматичних вуглеводнів на галоген утворюються галогенопохідні; при реакціях з концентрованою азотною абосірчаною кислотами — нітросполуки або сульфосполуки.
Ароматичні вуглеводні майже не здатні до реакцій приєднання.
· Реакція горіння (на прикладі бензолу):
2 C6H6 + 15 O2 → 12 CO2 + 6 H2O
Арени горять кіптявим полум'ям, що свідчить про великий вміст Карбону.
· Реакції заміщення.
· Галогенування (на прикладі бензолу):
C6H6 + Br2 (чиста речовина) → C6H5Br + HBr
Реакція відбувається за умови каталізатора FeCl3 і простої речовини Br2 у чистому вигляді до утворення хлорбензолу і бромідної кислоти.
На прикладі толуену:
C6H5CH3 + 3 Br2 (водний розчин) → C6H5Br3CH3 + 3 HBr
При заміщенні аренів атомом Хлору (Cl) використовується каталізатор AlCl3
Нітрування (на прикладі бензолу):
C6H6 + HONO2 → C6H5NO2 + H2O
В результаті взаємодії бензолу і нітратної кислоти утворюється нітробензен і вода. В результаті реакції утворюється жовта рідина і запах гіркого мигдалю, що є якісною реакцією на бензен. Реакція відбувається за наявності каталізатора H2SO4 (концентрованого розчину) - сульфатної кислоти, що є дуже гігроскопічною речовиною і поглинає воду, а також високої температури.
· Окиснення (на прикладі толуену):
C6H5CH3 + 3 [O] C6H5COOH + H2O
Окисником виступає KMnO4 (перманганат калію). В результаті окиснення утворюється бензойна кислота, оксид Мангану(IV) і вода. Під час реакції відбувається знебарвлення розчину перманганату калію.
· Гідрування (на прикладі бензолу):
C6H6 + 3 H2 → C6H12
При приєднанні до бензолу атомів водню утворюється циклогексан. Відбувається розірвання подвійних зв'язків (у формулі Кекуле). Реакція відбувається за наявності нікелевого каталізатора і підвищеної температури

Хлорування (на прикладі бензолу):
C6H6 + 3 Cl2 → C6H6Cl6
При приєднанні до бензолу атомів хлору утворюється гексахлорциклогексан (гексахлоран). Реакція відбувається лише за наявності світла.
24. Аре́ни (також аромати́чні вуглево́дні) — органічні сполуки, які належать до класу карбоциклічних сполук. У складі молекули ароматичних вуглеводнів є одна або кілька груп з 6 атомів вуглецю(Карбону), сполучених у кільце (бензенове ядро) простими і подвійними зв'язками (формула Кекуле). За сучасними уявленнями, атоми Карбону в бензеновому ядрі сполучені електронами двох типів: одні електрони містяться в площині молекули, інші розміщені перпендикулярно до неї.
Найпростішим представником ароматичних вуглеводнів є бензен, складнішими — нафтален, антрацен, які мають кілька бензенових ядер.
Ароматичні вуглеводні відзначаються особливою здатністю до реакцій заміщення і стійкістю бензенового ядра. При заміні водню в ароматичних вуглеводнів на галоген утворюються галогенопохідні; при реакціях з концентрованою азотною або сірчаною кислотами — нітросполуки або сульфосполуки.
Ароматичні вуглеводні майже не здатні до реакцій приєднання.
Реакція горіння (на прикладі бензолу):
2 C6H6 + 15 O2 → 12 CO2 + 6 H2O
Арени горять кіптявим полум'ям, що свідчить про великий вміст Карбону.
Реакції заміщення.
Галогенування (на прикладі бензолу):
C6H6 + Br2 (чиста речовина) → C6H5Br + HBr
Реакція відбувається за умови каталізатора FeCl3 і простої речовини Br2 у чистому вигляді до утворення хлорбензолу і бромідної кислоти.
На прикладі толуену:
C6H5CH3 + 3 Br2 (водний розчин) → C6H5Br3CH3 + 3 HBr
Реакція відбувається за звичайних умов при взаємодії толуену з бромною водою (розчин простої речовини брому у воді) до утворення 2,4,6-трибромтолуену (2,4,6-бром-1-метилбензен) - білого осаду (якісна реакція на толуен) і бромідної кислоти у співвідношенні 1:3
При заміщенні аренів атомом Хлору (Cl) використовується каталізатор AlCl3
Нітрування (на прикладі бензолу):
C6H6 + HONO2 → C6H5NO2 + H2O
В результаті взаємодії бензолу і нітратної кислоти утворюється нітробензен і вода. В результаті реакції утворюється жовта рідина і запах гіркого мигдалю, що є якісною реакцією на бензен. Реакція відбувається за наявності каталізатора H2SO4 (концентрованого розчину) - сульфатної кислоти, що є дуже гігроскопічною речовиною і поглинає воду, а також високої температури.
Окиснення (на прикладі толуену):
C6H5CH3 + 3 [O] C6H5COOH + H2O
Окисником виступає KMnO4 (перманганат калію). В результаті окиснення утворюється бензойна кислота, оксид Мангану(IV) і вода. Під час реакції відбувається знебарвлення розчину перманганату калію.
Приєднання.
Гідрування (на прикладі бензолу):
C6H6 + 3 H2 → C6H12
При приєднанні до бензолу атомів водню утворюється циклогексан. Відбувається розірвання подвійних зв'язків (у формулі Кекуле). Реакція відбувається за наявності нікелевого каталізатора і підвищеної температури
Хлорування (на прикладі бензолу):
C6H6 + 3 Cl2 → C6H6Cl6
При приєднанні до бензолу атомів хлору утворюється гексахлорциклогексан (гексахлоран). Реакція відбувається лише за наявності світла.
У великій кількості вони містяться в кам'яновугільній смолі, яку одержують при коксуванні вугілля.
Назва «ароматичні» виникла в зв'язку з тим, що перші сполуки цього класу добували з природних запашних речовин.
CnH2n-6 – загальна формула.
25. Спирти — похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені гідроксильними групами (-OH). Гідроксильну групу зв'язану з sp3-гібридизованим атомом Карбону називають спиртовою. Органічні сполуки з двома гідроксильними групами називаються діолами, з трьома — тріолами і т. д. В українській мові їх також називають багатоатомними спиртами.
Спирти також мають загальну назву — алканоли та алкоголі.
Правила складання назви спиртів ґрунтуються на правилах для алканів з деякими доповненнями:
1. Назва спиртів походить від назви відповідного алкану зміною суфікса -ан на -ол.
2. Оскільки існують спирти з однаковою кількістю атомів Карбону в молекулі, в яких ОН-група приєднана до різних атомів Карбону, то слід також указувати положення гідроксильної групи (пропанол-1, пропанол-2, гексанол-3 тощо).
3. При складанні назв спиртів розгалуженої будови нумерацію карбонових атомів починають із того кінця, ближче до якого гідроксильна група, у назві спершу позначають місця відгалужень, а потім положення гідроксильної групи (2-метилпропанол-1, 3-метилбутанол-1 тощо). Таким чином, тут зберігається той самий принцип, що й у ненасичених сполуках.
Номенклатура багатоатомних спиртів майже не відрізняється від номенклатури одноатомних спиртів, окрім одного додаткового правила, пов’язаного з більшою кількістю гідроксильних груп: перед суфіксом -ол, що означає гідроксильну групу, у назві спирту вказують кількість цих груп. Окрім того, за традицією, двохатомні спирти також називають гліколями.
26.. Загальна формула насичених альдегідів СnН2nO.
| Формула | Назва IUРАС | Тривіальна назва |
| НСНО | Метаналь | Формальдегід, мурашиний альдегід |
| CH3CHO | Етаналь | Ацетальдегід, оцтовий альдегід |
| C2H5CHO | Пропаналь | Пропіоновий альдегід |
| C3H7CHO | Бутаналь | Масляний альдегід |
| С4Н9СНО | Пентаналь | Валеріановий альдегід |
Назва альдегідів за номенклатурою ІUРАС утворюється додаванням суфікса -аль до назв відповідних алканів. Однак деякі альдегіди мають свої історично сформовані тривіальні назви, які зустрічаються в літературі значно частіше, ніж назви за міжнародною номенклатурою.
1) Повне окиснення (горіння):
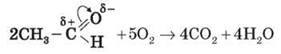
2) Приєднання водню до альдегідів (гідрування) здійснюється в присутності каталізаторів (Ni, Co,Pd та ін.) і приводить до утворення первинних спиртів:
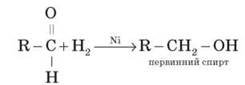
*Часто як відновлювальний агент застосовують літій алюмогідрид LiAlH4 і натрій борогідридNaBH4.Крім реакцій приєднання за карбонільною групою, для альдегідів характерними є також реакції окиснення.
3) Окиснення. Альдегіди легко окислюються, утворюючи відповідні карбонові кислоти:

4) Формальдегід легко полімеризується з утворенням циклічних і лінійних полімерів. Так, у кислому середовищі він утворює циклічний тример — триоксиметилен.
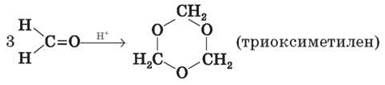
Сухий газоподібний формальдегід у присутності каталізаторів утворює високомолекулярний поліформальдегід. Полімеризація формальдегіду нагадує полімеризацію алкенів.

 У водних розчинах формальдегід утворює полімер, який називається параформом.
У водних розчинах формальдегід утворює полімер, який називається параформом.
 5) Особливе практичне значення має реакція поліконденсації формальдегіду з фенолом з утворенням феноло-формальдегідних смол. У разі дії лужних або кислих каталізаторів на суміш фенолу й формальдегіду конденсація відбувається в орто- й пара-положеннях.
5) Особливе практичне значення має реакція поліконденсації формальдегіду з фенолом з утворенням феноло-формальдегідних смол. У разі дії лужних або кислих каталізаторів на суміш фенолу й формальдегіду конденсація відбувається в орто- й пара-положеннях.
27.. Карбонові кислоти – органічні сполуки, що містять одну або декілька карбоксильних груп COOH. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавелева, фталева, азелаїнова кислота) та багатоосновні (лимонна кислота). До складу К. к. можуть входити також інші функціональні групи, наприклад, –OH, –NH2, –C=O. К. к. значно слабші за мінеральні кислоти. Ароматичні К. к. сильніші за насичені аліфатичні. Утворюють солі та різні похідні речовини: галогенангідриди, аміди, естери. Мають різноманітне промислове застосування і велике біологічне значення. У молекулах К. к., як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами. Але в кислотах гідроксильна група перебуває під впливом групи атомів карбоксилу, в той час як в спиртах на неї впливає вуглеводневий радикал. Вплив карбонільної групи на гідроксил проявляється, зокрема, в тому, що атом водню гідроксильної групи в кислотах значно більш «кислотний», ніж у спиртах: легше заміщується металом і може відщеплюватися у вигляді катіона, наприклад: CH3COOH ↔ CH3COO– + H+
З лугом ці кислоти утворюють солі: CH3COOH + NaOH → CH3COONa + H2O
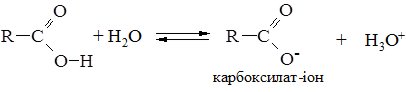 кислоти є слабкими кислотами, тому їх солі зазнають гідролізу. Залежно від числа карбоксильних груп в молекулі, карбонові кислоти підрозділяються на одноосновні (суфікс -ова), двоосновні (суфікс -диова), триосновні (суфікс -триова), тощо.
кислоти є слабкими кислотами, тому їх солі зазнають гідролізу. Залежно від числа карбоксильних груп в молекулі, карбонові кислоти підрозділяються на одноосновні (суфікс -ова), двоосновні (суфікс -диова), триосновні (суфікс -триова), тощо.
У водних розчинах карбонові кислоти дисоціюють з утворенням стабільного карбоксилат-іона, в якому негативний заряд рівномірно розподілений (делокалізований) між двома атомами Оксигену:
Реакція естерифікації (взаємодія зі спиртами). Естери. Взаємодія карбонових кислот зі спритами відбувається при нагріванні в присутності Н+, при цьому утворюються естери карбонових кислот, тому цю реакцію називають “реакція естерифікації” (гр. aestus – клуби випаровувань і лат. facere – робити).
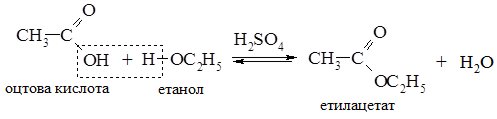
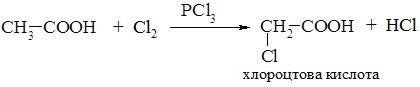
Галогенування карбонових кислот. Реакція карбонових кислот з галогенами призводить до заміщення атома Гідрогену біля атома Карбону, що зв’язаний з карбоксильною групою:
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2182; Нарушение авторских прав?; Мы поможем в написании вашей работы!