
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості алканів
|
|
|
|
Основні положення теорії хімічної будови органічних сполук
• у хімічних сполуках атоми з'єднуються між собою у певному порядку відповідно до їх валентності, що визначає хімічну будову молекул;
• хімічні і фізичні властивості органічних сполук залежать як від природи і кількості атомів, що входять до їх складу, так і від хімічної будови молекул;
• для кожної емпіричної формули можна вивести певну кількість теоретично можливих структур (ізомерів);
• кожна органічна речовина має лише одну формулу хімічної будови, яка дає уявлення про властивості даної сполуки;
• у молекулах існує взаємний вплив атомів як безпосередньо звязаних, так і безпосередньо не звязаних один з одним.
21. Алкани – вуглеводні аліфатичного ряду, в молекулах яких всі атоми Карбону зв’язані між собою лише простими зв’язками. Їх ще називають насиченими вуглеводнями, оскільки вони не містять вільних валентностей і до них не може приєднатися водень. Не існує вуглеводнів, які б містили більше атомів Гідрогену, ніж алкани.
Загальна формула алканів CnH2n + 2.
| Властивості | Умови | Рівняння реакцій |
| 1. горіння | СnH2n+2 + x O2 → y CO2 + z H2O | |
| 2. хлорування (реакція заміщення) | hν, сильне освітлення | hν СnH2n+2 → СnH2n+1 Сl + HCl Поступово заміщуються атоми Гідрогену. |
| 1. термічний розклад | t0 > 1000 0C | C3H8 → 3C + 4H2 |
| 4.відщеплюють водень (реакція дегідрування) | t0, каталізаторNi | СН3 ─ СН2 ─ СН2 ─ СН3 → СН2 = СН ─ СН2 ─ СН3 + Н2 |
22) АЛКЕНИ
Алке́ни (рос. алкены, англ. alkenes, нім. Alkene, Alkylene), ненасичені ациклічні вуглеводні, називані також олефінами, що мають загальну формулу CnH2n. Легкі алкени, наприклад, етилен і пропілен — гази, які отримують з фракцій при крекінгу нафти. Алкени мають один або більше подвійних зв'язків між атомами вуглецю, тому називаються ненасиченими. Інша назва — олефіни.
Олефіни широко застосовуються для отримання полімерів, а також і для синтезу похідних олефінів: дихлоретану, етиленгліколю,ізопропілового спирту, ацетону, нітрилу акрилової кислоти і багатьох інших з'єднань, які мають велике значення.[1]
| Властивості | Алкени |
1. Приєднання водню. Приєднання водню (реакція гідрування) до алкенів проводять у присутності каталізаторів. Найчастіше використовують подрібнені метали – платину, нікель, паладій та ін. В результаті утворюються відповідні алкани (насичені вуглеводні).
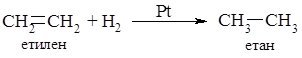
2. Приєднання галогенів. Алкени легко за звичайних умов вступають у реакції з хлором та бромом з утворенням відповідних дигалогеналканів, у яких атоми галогену знаходяться біля сусідніх атомів Карбону.
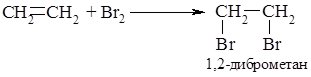
При взаємодії алкенів з бромом спостерігається знебарвлення жовто-бурого забарвлення брому. Це одна із найстаріших та найпростіших якісних реакцій на ненасичені вуглеводні, оскільки аналогічно реагують також алкіни та алкадієни.
3. Приєднання галогеноводнів. При взаємодії етиленових вуглеводнів з галогеноводнями (HCl, HBr) утворюються галогеналкани, напрям реакції залежить від будови алкенів.
У випадку етилену або симетричних алкенів реакція приєднання відбувається однозначно і веде до утворення лише одного продукту:

4. Приєднання води. Алкени приєднують воду у присутності кислотних каталізаторів. Найчастіше використовують сульфатну або ортофосфатну кислоти. Продуктами реакції є спирти:

5. Окиснення. Алкени, на відміну від алканів, легко вступають в реакції окиснення. Так, етиленові вуглеводні при кімнатній температурі окиснюються калій перманганатом (реакція Вагнера). При обробці алкенів розбавленим розчином KMnO4 утворюються двоатомні спирти, які містять дві гідроксильні групи:

Ця реакція має аналітичне значення, оскільки при її проходженні фіолетовий розчин калій перманганату знебарвлюється. Так само як і реакція з бромною водою вона є якісною на ненасичені вуглеводні.
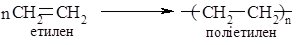
6. Реакції полімеризації. Органічні сполуки з кратними зв’язками здатні сполучатись між собою з утворенням довгих ланцюгових молекул. Якщо дві молекули сполучаються між собою, то продуктом реакції є димер, якщо три – тример і т.д. Сполучення великої кількості молекул між собою веде до утворення полімеру (гр. poly – багато, meros – частина). Так молекули етилену внаслідок розриву подвійного зв’язку здатні зв’язуватись між собою з утворенням поліетилену:
23)АЛКІНИ
Алкі́ни, ацетиле́нові вуглево́дні, члени групи вуглеводнів із загальною формулою CnH2n-2, називаються також ацетиленами, за тривіальною назвою першого предстаника гомологічного ряду, ненасичені сполуки; характеризуються одним чи більше потрійними зв'язками між атомами вуглецю.
1. Галогенування. Галогени приєднуються до алкінів у дві стадії. Наприклад, приєднанняброму до ацетилену призводить до утворення диброметену, який, у свою чергу, реагує з надлишком Вr2 з утворенням тетраброметану:

Алкіни, так само як і алкени, знебарвлюють бромну воду.
2. Гідрогалогенування. Галогеноводні приєднуються до потрійного зв’язку важче, ніж до подвійного. Для активації галогеноводню використовують АlСl3. З ацетилену при цьому можна добувати вінілхлорид (хлоретен), який використовують для добування важливого полімеру — полівінілхлориду:
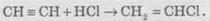
У разі надлишку галогеноводню відбувається повне гідрогалогенування, причому для несиметричних алкінів на кожній стадії приєднання йде за правилом Марковникова, наприклад:
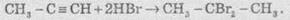
3. Гіоратація. Приєднання води до алкінів каталізується солями ртуті (II):

У результаті реакції гідратації тільки ацетилен перетворюється в альдегід; гідратація гомологів ацетилену протікає за правилом Марковникова, і утворені еноли ізомеризуються в кетони. Наприклад, пропін перетворюється в ацетон:
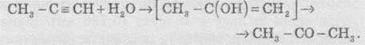
Реакцію гідратації алкінів відкрив М.Г. Кучеров (1881 р.), саме тому її й називають реакцією Кучерова.
4. Кислотні властивості. Особливістю алкінів, що мають кінцевий кратний зв’язок, є їхня здатність відщеплювати протон під дією сильних основ, тобто проявляти слабкі кислотні властивості. Таким чином, алкіни, на відміну від алкенів та алканів, здатні утворювати солі, які називають ацетиленідами:

Ацетиленіди Аргентуму и Купруму(I) легко утворюються й випадають в осад при пропусканніацетилену через аміачний розчин аргентум оксиду або купрум(І) хлориду. Ці реакції слугують для виявлення алкінів з потрійним зв’язком у кінці ланцюга:
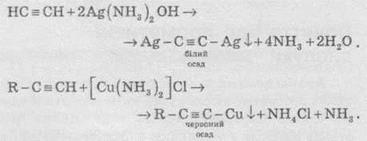
5. Полімеризація. У присутності каталізаторів алкіни можуть реагувати один з одним, причому залежно від умов утворюються різні продукти. Так, під дією водного розчину СuСl та NH4Clацетилен димеризується, утворюючи вінілацетилен:

Вінілацетилен має велику реакційну здатність, приєднуючи хлороводень, він утворює хлоропрен, який використовують для добування штучного каучуку:

При пропусканні ацетилену над активованим вугіллям при температурі +600 °С відбувається тримеризація ацетилену з утворенням бензену:
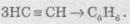
В аналогічні реакції тримеризації можуть також вступати й найближчі гомологи ацетилену, наприклад:

6. Реакції окиснення й відновлення. Алкіни легко окиснюються різними окисниками, зокрема калій перманганатом. При реакції розчин калій перманганату знебарвлюється, що свідчить про наявність потрійного зв’язку. При окисненні зазвичай відбувається розщеплення потрійного зв’язку, утворюються карбонові кислоти:

У присутності металевих каталізаторів алкіни відновлюються шляхом послідовного приєднання молекул водню, перетворюючись спочатку в алкени, а потім в алкани:

|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1592; Нарушение авторских прав?; Мы поможем в написании вашей работы!