
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні типи молекулярних зв’язків – іонний, ковалентний. Квантово-механічне пояснення ковалентного зв’язку
|
|
|
|
Структурна і просторова ізомерія. Фізичні методи визначеннях структури.
Ізомерія (від з... і греч.(грецький) méros — доля, частина) хімічних сполук, явище, що полягає в існуванні речовин, однакових по складу і молекулярній масі, але що розрізняються по будові або розташуванню атомів в просторі і внаслідок цього по фізичних і хімічних властивостях. Такі речовини називаються ізомерами.Розрізняють два основні види І.: структурну і просторову (стереоізомерію). Структурні ізомери відрізняються один від одного порядком зв'язків між атомами в молекулі; стереоізомери — розташуванням атомів в просторі при однаковому порядку зв'язків між ними.Структурна І. підрозділяється на декілька різновидів. І. скелета обумовлена різним порядком зв'язку між атомами вуглецю, створюючими скелет молекули. Так, може існувати лише один нециклічний насичений вуглеводень з трьома атомами З — пропан (I). Вуглеводнів такого ж типа з чотирма атомами З може бути вже два: н -бутан (II) і ізобутан (III), а з п'ятьма атомами З — три: н -пентан (IV), ізопентан (V) і неопентан (VI). Просторова І. підрозділяється на два види: геометричну І. (або цис-транс -І.) і оптичну І. Геометрічеськая І. властива з'єднанням, що містять подвійні зв'язки (З = З, C = N і ін.), і неароматичним циклічним з'єднанням; вона обумовлена неможливістю вільного обертання атомів довкола подвійного зв'язку або в циклі. У цих випадках заступники можуть бути розташовані або по одну сторону плоскості подвійного зв'язку або циклу (цис - положення), або по різні сторони (транс - положення). Поняття «цис» і «транс» зазвичай відносять до пари однакових заступників, а якщо всі заступники різні, то умовно до однієї з пар. Прикладами геометричних ізомерів можуть служити дві форми етилен-1,2-дикарбоновой кислоти — цис -форма, або малеїнова кислота (XXX), і транс - форма, або фумарова кислота (XXXI), а також цис - і транс - форми циклопропан-1,2-дикарбоновой кислоти (відповідно XXXII і XXXIII).
Ковалентний зв’язок — це хімічний зв’язок, який здійснюється між атомами за рахунок електронних пар, що однаковою мірою належать обом атомам. Ковалентний зв’язок, утворений однаковими атомами (з однаковою електронегативністю), називається неполярним, а утворений різними атомами (з різною електронегативністю), — полярним.Електрони, здатні брати участь в утворенні хімічного зв’язку, називаються валентними. Їх кількість визначає число зв’язків, що утворюються атомом, тобто валентність. Йонний зв’язок — це зв’язок, зумовлений електростатичним тяжінням між різнойменно зарядженими йонами. Металічний зв’язок — це зв’язок між позитивними йонами металів, що знаходяться у вузлах кристалічних ґраток, який здійснюється за рахунок електронів, що вільно переміщаються по кристалу. Водневий зв’язок — це зв’язок між позитивно зарядженим атомом Гідрогену однієї молекули і негативно зарядженим атомом іншої молекули. Водневий зв’язок має частково електростатичний, частково донорно-акцепторний характер.
13. Сили міжмолекулярної взаємодії. Сили Ван-дер- Ваальса. Ізотерми Ван-дер-Ваальса. Рівняння Ван дер Ваальса — модельне рівняння стану неідеального газу. 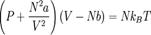 .де P — тиск, V — об'єм, N — число молекул, T — температура, kB — стала Больцмана, a та b — характерні для кожного реального газу сталі, які будуть визначені нижче.Рівняння ван дер Ваальса описує збільшення тиску при зменшенні об'єму розріджених газів, перенасичену пару, перегріту рідину, різке зменшення стисливості в рідкій фазі. Рівняння ван дер Ваальса визначає також критичну температуру, вище якої газ не зріджується при жодному тиску. Фактично рівняння Ван дер Ваальса описує різницю між станом реального та ідеального газів. Розглянемо типову ізотерма для рівняння ван дер Ваальса. При великих об'ємах зі зменшенням об'єму тиск збільшується. Проте на ізотермі є ділянка (позначена червоним) для якої тиск падає зі зменшенням об'єму. Збільшення тиску при зменшенні об'єму є унівенсальним законом фізики.На кривій ізотерми ван дер Ваальса існують ще дві ділянки Ці ділянки відповідають метастабільним станам. ділянка кривої ван дер Ваальса відповідає переохолодженому газу, тобто стану, в якому конденсація ще не розпочалася, хоча стан (горизонтальна крива), у якому краплини рідини співіснують з газом, є найстабільнішим. Метастабільний стан переохолодженої рідини можна реалізувати експериментально. Він знайшов застосування в камерах Вільсона. Рідина легко переходить із переохолодженого стану в стабільний стан на горизонтальній кривій.Друга ділянка – дылянка перегрітої рідини. Перегріта рідина є метастабільним станом. Вона теж використовується в ядерній фізиці для детектування треків швидких частинок у бульбашкових камерах
.де P — тиск, V — об'єм, N — число молекул, T — температура, kB — стала Больцмана, a та b — характерні для кожного реального газу сталі, які будуть визначені нижче.Рівняння ван дер Ваальса описує збільшення тиску при зменшенні об'єму розріджених газів, перенасичену пару, перегріту рідину, різке зменшення стисливості в рідкій фазі. Рівняння ван дер Ваальса визначає також критичну температуру, вище якої газ не зріджується при жодному тиску. Фактично рівняння Ван дер Ваальса описує різницю між станом реального та ідеального газів. Розглянемо типову ізотерма для рівняння ван дер Ваальса. При великих об'ємах зі зменшенням об'єму тиск збільшується. Проте на ізотермі є ділянка (позначена червоним) для якої тиск падає зі зменшенням об'єму. Збільшення тиску при зменшенні об'єму є унівенсальним законом фізики.На кривій ізотерми ван дер Ваальса існують ще дві ділянки Ці ділянки відповідають метастабільним станам. ділянка кривої ван дер Ваальса відповідає переохолодженому газу, тобто стану, в якому конденсація ще не розпочалася, хоча стан (горизонтальна крива), у якому краплини рідини співіснують з газом, є найстабільнішим. Метастабільний стан переохолодженої рідини можна реалізувати експериментально. Він знайшов застосування в камерах Вільсона. Рідина легко переходить із переохолодженого стану в стабільний стан на горизонтальній кривій.Друга ділянка – дылянка перегрітої рідини. Перегріта рідина є метастабільним станом. Вона теж використовується в ядерній фізиці для детектування треків швидких частинок у бульбашкових камерах
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 451; Нарушение авторских прав?; Мы поможем в написании вашей работы!