
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон дюлонга та пті
|
|
|
|
Закон Дюлонга-Пті визначає питому теплоємність твердого тіла за формулою
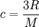
де c - питома теплоємність, R - універсальна газова стала, M - молярна маса.
Закон Дюлонга-Пті справедливий при температурах вищих за температуру Дебая.
Щоб підвищити температуру потрібно збільшити кінетичну енергію руху кожного із атомів твердого тіла. Однак, внаслідок сильної взаємодії атомів між собою, збільшення кінетичної енергії потребує рівного за величиною збільшення потенціальної енергії. Тому теплоємність твердого тіла вдвічі більша за теплоємність ідеального газу.
Закон Дюлонга-Пті можна переписати для теплоємності твердого тіла у вигляді:
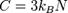 ,
,
де С - теплоємність, kB - стала Больцмана, N - число атомів у кристалі.
Для справедливості закону Дюлонга-Пті необхідно, щоб енергії теплового руху вистачало для збудження всіх можливих типів коливань у твердому тілі. При низьких температурах закон Дюлонга-Пті не діє.
6. Адіаба́тний проце́с — в термодинаміці зміна стану тіла без обміну теплом з навколишнім середовищем. Його можна здійснити, проводячи стискання чи розширення тіла (наприклад, газу) дуже швидко.
Рівняння адіабати - 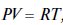 де P=RT:V; V=RT:P; T=PV:R
де P=RT:V; V=RT:P; T=PV:R
7. Цикл Карно́ — ідеальний термодинамічний цикл.
Цикл складається з чотирьох стадій:
1. Робоча речовина нагрівається за сталої температури (ізотермічний процес).
2. Робоча речовина розширюється за сталої ентропії (адіабатичний процес).
3. Робоча речовина охолоджується за сталої температури (ізотермічний процес).
4. Робоча речовина стискається за сталої ентропії (адіабатичний процес).
Коефіцієнт корисної дії теплової машини - 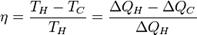
8.теплові властивості реальних середовищ. Температурна діаграма процесу нагрівання речовини
Температура характеризує величину нагрівання тіла і визначає напрямок передачі теплоти. Якщо 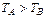 , то теплота переходить від тіла А до тіла В. При цьому температура тіла А зменшується, а температура тіла В збільшується. Якщо
, то теплота переходить від тіла А до тіла В. При цьому температура тіла А зменшується, а температура тіла В збільшується. Якщо 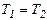 , то самовільного переходу теплового потоку між ними не буде.
, то самовільного переходу теплового потоку між ними не буде.
Числове значення термодинамічної абсолютної температури можна визначити з рівняння у вигляді:
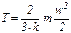 .
.
Таким чином, у термодинаміці температура розглядається як середньостатистична величина, що характеризує систему, яка складається з величезного (але кінечного) числа молекул, які знаходяться у хаотичному (тепловому) русі.
У технічній термодинаміці в якості робочого тіла розглядається ідеальний газ - теоретична модель реального газу, в якій не враховується взаємодія часток газу, молекул, що являють собою безоб’ємні матеріальні точки; силами міжмолекулярного зчеплення зневажають. Це дає підставу кожен дійсно існуючий у природі газ, в якому можна знехтувати силами зчеплення та об'ємом молекул (через малу їх величину), називати ідеальним газом. Ця обставина тим більш справедлива, чим вище температура газу і менше тиск.
9. Питома теплота плавлення та пароутворення речовини
Тіла, які зовні здаються твердими, не завжди є такими з точки зору фізики. Істинно тверді тіла мають кристалічну структуру, з упорядкованістю молекул чи атомів у межах всього кристалу (з дальнім порядком).
При нагріванні кристалічної речовини зростає хаотичність руху її молекул, і за досить високої температури зникає дальній порядок (відбувається процес плавлення). Температура кристалізації збігається з температурою плавлення. Від початку плавлення (і тверднення) і до закінчення кожного з цих процесів температура речовини залишається незмінною.
Пароутворення з поверхні речовини називається випаровуванням. Рідини випаровуються при будь-якій температурі, і навіть тверді речовини можуть слабко випаровуватись.
За досить високої температури до випаровування приєднується кипіння, тобто пароутворення зсередини рідини. У цьому процесі беруть участь повітряні бульбашки, що є в рідині.
Кипіння кожної рідини при незмінному тиску відбувається при цілком певній незмінній температурі. Чим більший тиск над рідиною, тим вища температура кипіння.
Процес переходу речовини з газоподібного стану у стан з більшою густиною називається конденсацією(ущільненням).
Шляхом конденсації пари утворюється ранкова роса (наприклад, на листі рослин), іній (на поверхні ґрунту, рослинах, будівлях тощо).
Фізична величина L, що має назву питомої теплоти пароутворення, вводиться подібно до вже розглянутих величини q і 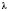 : чим більше рідини в якійсь посудині, тим довше триває повне перетворення її на пару, і тим більша потрібна для цього кількість теплоти.
: чим більше рідини в якійсь посудині, тим довше триває повне перетворення її на пару, і тим більша потрібна для цього кількість теплоти.
Отже: 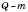 ,
, 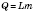 ,
, 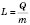 ,
, 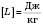 .
.
Для процесу конденсації 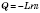 ; у цьому випадку L — питома теплота конденсації.
; у цьому випадку L — питома теплота конденсації.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2094; Нарушение авторских прав?; Мы поможем в написании вашей работы!