
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перше начало термодинаміки. Робота газу при сталому тиску
|
|
|
|
Зміна енергії тіла відбувається тільки при виконанні механічної роботи або при теплообміні. Закон збереження енергії є першим началом термодинаміки. Підведення до системи кількість теплоти Q частково іде на збільшення внутрішньої енергії системи 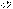 і частково на виконання цією системою роботи
і частково на виконання цією системою роботи 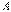
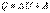
Вигляд цього рівняння для ізопроцесів: ізобаричний 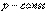 робота вих
робота вих 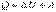 збільшується об’єм і підвищується температура. Процес в якій-небудь системі, що відбувається без теплообміну з оточуючим середовищем називається адіабатним процесом.
збільшується об’єм і підвищується температура. Процес в якій-небудь системі, що відбувається без теплообміну з оточуючим середовищем називається адіабатним процесом.  тоді
тоді 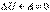
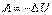 З цього випливає, що під час адіабатного процесу система може виконувати роботу тільки за рахунок зменшення своєї внутрішньої енергії.
З цього випливає, що під час адіабатного процесу система може виконувати роботу тільки за рахунок зменшення своєї внутрішньої енергії.
4. Теплоємність газу за сталого обєму і сталого тиску.
Кількість теплоти поглинутої тілом при зміні його стану залежить не лише від його початкового та кінцевого станів, зокрема, від його початкової та кінцевої температури, але і від способу, в який було здійснено перехід від початкового до кінцевого стану. Відповідно від цього залежить і теплоємність тіла. Звичайно, розрізняють теплоємність за сталого тиску CP і теплоємність за сталого об`єму CV, якщо в процесі нагрівання підтримують, відповідно, сталий тиск Р або сталий об`єм V. При нагріванні за сталого об’єму (V =const, ізохоричний процес) уся підведена до тіла теплота йде на збільшення його внутрішньої енергії, тоді як при нагріванні за сталого тиску (P =const, ізобаричний процес) на збільшення внутрішньої енергії тіла йде лише частина підведеної до тіла теплоти, оскільки інша частина йде на виконання роботи розширення тіла. Отже, CP завжди більше за CV. Для твердих тіл і рідин різниця між CP та CV незначна, оскільки зміни їх об’єму при нагріванні невеликі. Знання g є важливим, оскільки безпосереднє вимірювання CV становить значні експериментальні труднощі (при V =const маса газу, а отже його теплоємніcть завжди малі порівняно з відповідними величинами для калориметра), і теплоємність CV звичайно обчислюють за формулою CV = CP/ g, оскільки вимірювати CP значно зручніше.Для газів, розріджених настільки, щоб їх можна було вважати ідеальними, різниця молярних теплоємностей CP - CV = R, де R – універсальна газова стала, що дорівнює 8,314 Дж/(моль∙K). Відповідно до класичної теорії теплоємності ідеальних газів для одноатомного газу теплоємність CV = 3 R/2, для газу, що складається із двоатомних молекул, CV = 5 R/2, а для ідеального газу багатоатомних жорстких молекул CV = 6 R/2. Якщо газ можна вважати ідеальним, то за відомим відношенням молярних теплоємностей γ можна навіть знайти їх абсолютні величини. Можна знайти самі теплоємності CV = R/(g – 1 ) та CP = gR/(g – 1 ).
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 634; Нарушение авторских прав?; Мы поможем в написании вашей работы!