
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перший закон термодинаміки
|
|
|
|
Перший закон термодинаміки має різні, проте еквівалентні формулювання. Він є, фактично, законом збереження енергії: загальна енергія ізольованої системи залишається сталою, незалежно від того, які процеси відбуваються в ній.
Як уже зазначалось, стан системи визначається функціями стану, однією з яких є внутрішня енергія U. Із зміною внутрішньої енергії пов'язані всі енергетичні перетворення всередині системи. Внутрішня енергія залежить як від природи і кількості речовини, так і від умов її існування. Зміна внутрішньої енергії системи Δ U визначається різницею між кількостями наданої системі теплоти Q і роботою W, яку виконує система.
Отже, математичний вираз першого закону термодинаміки матиме вигляд:
ΔU = Q – W.
Інакше кажучи, підведена до системи теплота витрачається на зміну внутрішньої енергії ΔU та на виконання роботи W:
Q = ΔU + W.
При оборотному рівноважному процесі для нескінченно малої зміни стану системи зміна внутрішньої енергії, теплоти і роботи також будуть нескінченно малими і рівняння Q = ΔU + Wматиме вигляд:
¶Q = dU + ¶W.
Величина ¶W є сумою двох робіт – роботи проти сили зовнішнього тиску PdV ікорисної роботи ¶W':
¶W =PdV + ¶W'.
У більшості термодинамічних розрахунків враховують лише дію зовнішнього тиску на систему, а роботу ¶W' вважають рівною нулю, в цьому випадку:
¶Q = dU + PdV.
Теплота процесу може бути обчислена, якщо відома теплоємність системи, яка визначається співвідношенням:
 .
.
Для ізохорних процесів користуються поняттям теплоємності при сталому об'ємі СV, а для ізобарних – поняттям теплоємності при сталому тиску СР. Для ідеальних газів між Ср і Сvіснує залежність.
CP = CV + R.
Найважливішими термодинамічними процесами є наступні:
1. Ізотермічний процес:
Т = const; ΔU = nCVΔT = 0,
де CV – молярна теплоємність при сталому об'ємі.
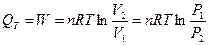 .
.
В ізотермічному процесі вся поглинена системою теплота іде на виконання роботи.
2. Ізохорний процес:
V = const; W = 0; Q v= Δ U.
Поглинена системою теплота іде на збільшення її внутрішньої енергії. Отже, Q vнабуває властивостей термодинамічної функції стану.
Теплота елементарного ізохорного процесу визначається за рівнянням:
¶ Q v= СvdТ.
При сталій теплоємності Сv теплоту ізохорного процесу можна обчислити за формулою:
Q v= Сv(Т2 – Т1).
3. Ізобарний процес:
р = const; W = р Δ V;
Qp = Δ U + p Δ V= U2 – U1 + p(V2 – V1) = U2 – U1 + PV2 – pV1 = (U2+PV2) – (U1+pV1).
Введемо позначення: U + pV = H (H – ентальпія), тоді: Qp = Н2 – Н1 = ΔН.
Теплота в ізобарному процесі дорівнює зміні ентальпії і не залежить від шляху процесу. Якщо теплоємність не залежить від температури, то можна використати формулу:
Q р= Ср(Т2 – Т1)= СрΔ Т.
4. Адіабатний процес:
Q = 0.
W = –ΔU = –nC vΔ T= –nC v (Т2 – Т1) = nC v (Т1 – Т2).
Робота виконується за рахунок зменшення внутрішньої енергії, і температура системи знижується.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1148; Нарушение авторских прав?; Мы поможем в написании вашей работы!