
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет23
|
|
|
|
Б22
Властивості кислот, основ і солей з точки зору теорії електролітичної дисоціації
Кислоти – сполуки, при розчиненні яких збільшується концентрація позитивно заряджених іонів розчинника. З точки зору теорії електролітичної дисоціації кислоти – електроліти, які у водному розчині дисоціюють з утворенням лише одного типу катіонів – гідратованях іонів Гідрогену.
Кількість іонів Гідрогену в молекулі кислоти, здатних заміщуватися на метал або металоподібну групу атомів з утворенням солей, визначає її основність. Розрізняють кислоти одноосновні (НNО3, НСl, НСlО), двохосновні (Н2SО4, Н2S, Н2СО3), триосновні (Н3РО4), чотириосновні (Н4Р2О7, Н4SіО4), п'ятиосновні (Н5ІО6), шестиосновні (Н6ТеО6). В деяких кислотах кількість атомів Гідрогену не відповідає їх основності: Н3РО3 – двохосновна, Н3РО2 – одноосновна кислота.
Основами називаються сполуки, молекули яких складаються з металу та гідроксидних груп — ОН.
Основи – це складні сполуки, що складаються з катіона, та гідроксид-іона. Загальна формула – M(OH)x. З точки зору теорії електролітичної дисоціації, основи – це електроліти, які у водному розчині дисоціюють з утворенням лише одного типу аніонів – гідроксид-іонів. За здатністю до дисоціації основи називаються лугами.
Основи у воді дисоціюють на йони металу (амонію у випадку гідрату амоніаку) і гідроксид-йони. Жодних інших аніонів, крім гідроксид-йонів, основи не утворюють.
3 точки зору теорії електролітичної дисоціації, солі – електроліти, які у водному розчині дисоціюють з утворенням позитивно заряджених іонів, що відрізняються від іона Гідрогену, та негативно заряджених іонів, що відрізняються від гідроксид-іона.
- Силіцій оксид SiO2
Безбарвна кристалічна речовина. Існує в різних алотропних модифікаціях, одна з них – напівдорогоцінний камінь кварц. Річковий та морський пісок – силіцій оксид з невеликою домішкою солей феруму(ІІІ)
Хімічні властивості:
Малоактивний кислотний оксид Взаємодія з Магнієм: SiO2 + 2Mg = 2MgO + Si
Розчинення в лугах при нагріванні: SiO2↓ + 2 KOH = K2SiO3 + H2O
Силікатна (кремнієва) кислота H2SiO3 - Аморфна безбарвна, слабка, нерозчинна у воді.
Особливі хімічні властивості. При висушуванні, а особливо при нагріванні, втрачає воду:H2SiO3 = H2O + SiO2
Силікати - Солі силікатної кислоти. Силікати більшості металів нерозчинні у воді.
Хімічні властивості: Взаємодія розчинних силікатів з кислотами Na2SiO3 + H2S = Na2S + H2SiO3↓
Карбон(IV) оксид (вуглекислий газ) — газ без кольору, смаку і запаху, важчий за повітря, добре розчиняється у воді, реагуючи з нею, легко скраплюється при кімнатній температурі й тиску 5 МПа. Твердий вуглекислий газ називають «сухим льодом».
Карбон(IІ) оксид (чадний газ) — газ без кольору і запаху. Погано розчиняється у воді, скраплюється при атмосферному тиску і температурі 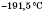 . Надзвичайно отруйний, викликає ядуху.
. Надзвичайно отруйний, викликає ядуху.
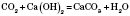
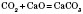
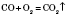
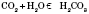 Хімічні властивості карбон оксидів.
Хімічні властивості карбон оксидів.
1) Взаємодія карбон(IV) оксиду з водою:
2) Взаємодія карбон(IV) оксиду з основними оксидами:
3) Взаємодія карбон(IV) оксиду з основами:
4) Взаємодія карбон(IІ) оксиду з киснем іде з виділенням великої кількості енергії:
Карбон(IV) оксид із киснем не взаємодіє.
Карбонатна (вугільна) кислота Н2СО3. Карбонати – це солі карбонатної кислоти. Карбонати поділяються на Гідрокарбонати (Розчинні у воді NaHCO3, Ca(HCO3)2) та Середні солі (Багатьох металів нерозчинні у воді CaCO3, FeCO3)
Хімічні властивості
- Взаємодія з кислотами (якісна реакція на карбонати) Na2CO3+ H2SO4 = Na2SO4 + CO2 ↑
NaHCO3 + HNO3 = NaNO3 + H2O + CO2 ↑
- Карбонати малоактивних металів розкладаються при нагріванні: FeCO3 = FeO + CO2
- Гідрокарбонати при нагріванні перетворюються на карбонати: 2NaHCO3 = Na2CO3 + CO2↑ + H2O↑
- Карбонати перетворюються на гідрокарбонати: CaCO3↓ + CO2 + H2O = Ca(HCO3)2
Розрізняють оборотний і необоротний гідроліз солей:
• 1. Гідроліз солі слабкої кислоти і сильної основи (гідроліз за аніоном).
(Розчин має слаболужну середу, реакція протікає оборотно, гідроліз по другому щаблі протікає в незначній мірі)
• 2. Гідроліз солі сильної кислоти і слабкої основи (гідроліз за катіоном).
(Розчин має слабокислую середу, реакція протікає оборотно, гідроліз по другому щаблі протікає в незначній мірі)
• 3. Гідроліз солі слабкої кислоти і слабкої основи.
(Рівновага зміщена в бік продуктів, гідроліз протікає практично повністю, так як обидва продукти реакції йдуть із зони реакції у вигляді осаду чи газу).
Сіль сильної кислоти і сильної основи не піддається гідролізу, і розчин нейтральний.
Бор
(borum, стар. назв. boracium і boron, останнім прийнято ще й тепер у англійців; хім. форм. В; атомна вага 11) - неметалічний елемент, у вільному стані відомий в двох алотропічних видозмінах: аморфному і кристалічному. У аморфному вигляді бор був отриманий в 1808 р. Люссаком і Тенаром і ближче вивчений в 1857 р. Велером і Сен-Клер-Девілля, що дали способи приготування кристалічного бору. У природі це тіло ніколи не зустрічається у вільному стані, але лише в з'єднанні з киснем у вигляді борної кислоти і деяких її солей. За властивостями своїм бор близько стоїть до вуглецю: звичайному вугіллю відповідає аморфний бор, який представляє порошок бурого кольору без смаку і запаху; кристалічний (або алмазний) бор по блиску і твердості дуже схожий з алмазом.
Бо́рная кислота́ (ортоборная кислота) — слабка кислота, яка має хімічну формулу H3BO3.
Безбарвне кристалічна речовина у вигляді лусочок без запаху, має багатошарову триклинную грати, в якій молекули кислоти з'єднані водневими зв'язками в плоскі шари, шари з'єднані між собою міжмолекулярними зв'язками (d= 0,318 нм).
Борна кислота виявляє дуже слабкі кислотні властивості. Вона порівняно мало розчинна у воді. Її кислотні властивості обумовлені не відщепленням протона Н+, а приєднанням гідроксильного аніона.
Тетраборат натрію («бура») - Na2B4O7, сіль слабкою борної кислоти і сильного підстави, поширене з'єднання бору, має кілька перенаправлено, широко застосовується в техніці.
Антисептика (лат. anti - проти, septicus - гниття) - система заходів, спрямованих на знищення мікроорганізмів в рані, патологічному вогнищі, органах і тканинах, а також в організмі хворого в цілому, що використовує механічні і фізичні методи впливу, активні хімічні речовини та біологічні чинники.
Термін був введений в 1750 році англійським хірургом Дж. Принглом, описавшем антисептичну дію хініну.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 449; Нарушение авторских прав?; Мы поможем в написании вашей работы!