
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Плюмбум
|
|
|
|
СТАНУМ
Метали
Б24
Окисно-відновні реакції — це реакції, внаслідок яких змінюються ступені окиснення елементів.
Окисник — це частка, що приймає електрони; процес приєднання електронів називають відновленням.
Відновник — це частка, що віддає електрони; процес віддавання електронів називають окисненням.
Окисником та відновником прийнято також називати речовини, до складу яких входять відповідні частки.
| Найважливіші окисники | Продукт їх відновлення |
| Кисень О2 | О2- у складі оксидів |
| Галогени Х2 (X=F, СІ, Вr) | X- у складі солей або ковалентних галогенідів |
| HNO3 | з металами Сu та праворуч в електрохімічному ряду металів: N02 з металами від Мg до Сu: N0, N2 з Мg та ліворуч: NH4NО3 |
| H2SO4 концентрована | з неметалами і малоактивними металами: SO2 з активними металами: S з дуже активними металами: Н2S |
| КМnO4 (в розчині) | у кислому середовищі: Мп2+ у складі солі у нейтральному середовищі: МnO2 у лужному середовищі: МnO42- |
| Найважливіші відновники | Продукт їх окиснення |
| Водень Н2 | Н+ звичайно у складі Н20 |
| Метали Me | Me+n у складі солей |
| Вуглець С | С+4 звичайно у складі СО2 |
| Сірководень H2S | S або SO42- залежно від умов |
Елементи-метали в Періодичній системі
Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп).
Атоми металів порівняно легко віддають електрони, перетворюючись на позитивно заряджені йони. Це пояснюється тим, що в атомів металів:
— мале число електронів на зовнішньому енергетичному рівні та є вільні валентні орбіталі (лужні, лужноземельні метали, метали III групи);
— електронами заповнюється передостанній енергетичний рівень; на зовнішньому рівні один або два електрони (метали побічних підгруп, d -елементи);
— електрони розміщуються відносно далеко від ядра (Полоній, Бісмут, Стибій).
Хімічні властивості металів
Метали розрізняються між собою хімічною активністю, тобто здатністю вступати в хімічні реакції. Їх можна розташувати в ряд за зменшенням активності (див. таблицю).
Метали — відновники. Отже, вони вступатимуть у хімічні реакції з окисниками.
1) Взаємодія з простими речовинами — неметалами (див. таблицю).
2) Взаємодія з кислотами. Метали, що стоять у ряду стандартних електродних потенціалів до Гідрогену, витісняють водень із розбавлених кислот, окрім нітратної:
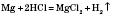
3) Взаємодія з солями. Активніші метали витісняють менш активні з розчинів їх солей:
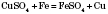
4) Взаємодія з водою.
Активні метали, що стоять у ряду стандартних електродних потенціалів до Алюмінію включно, реагують із водою з утворенням основ і водню:
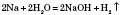
Метали, що стоять у ряду стандартних електродних потенціалів після Алюмінію, реагують із водою під час нагрівання з утворенням оксидів і водню:
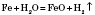
Метали, що стоять у ряду стандартних електродних потенціалів після Гідрогену, з водою не реагують.
5) Метали, гідроксиди яких амфотерні, реагують і з кислотами, і з основами:
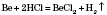
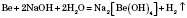
Загальні способи добування металів. Електроліз розплавів солей і лугів
Металургія — це галузь промисловості, яка займається видобуванням металів із руд.
Електроліз — окисно-відновний процес, що відбувається на електродах під час проходження електричного струму через розплав або розчин електроліту.
Якщо в розплав електроліту, наприклад натрій хлориду, занурити інертні електроди й пропускати постійний електричний струм, то катіони 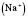 рухаються до катода — негативно зарядженого електрода, а аніони
рухаються до катода — негативно зарядженого електрода, а аніони 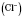 — до анода — позитивно зарядженого електрода. На аноді відбувається процес окиснення, на катоді — відновлення. Металевий зв'язок. Зв'язок, який утвориться внаслідок взаємодії відносно вільних електронів з іонами металів, називаються металевим зв'язком. Цей тип зв'язку характерний для простих речовин- металів. Суть процесу утворення металевого зв'язку складається в наступному: атоми металів легко віддають валентні електрони і перетворюються в позитивні заряджені іони. Відносно вільні електрони, що відірвалися від атома, переміщаються між позитивними іонами металів. Між ними виникає металевий зв'язок, т. е. Електрони як би цементують позитивні іони кристалічних ґраток металів.
— до анода — позитивно зарядженого електрода. На аноді відбувається процес окиснення, на катоді — відновлення. Металевий зв'язок. Зв'язок, який утвориться внаслідок взаємодії відносно вільних електронів з іонами металів, називаються металевим зв'язком. Цей тип зв'язку характерний для простих речовин- металів. Суть процесу утворення металевого зв'язку складається в наступному: атоми металів легко віддають валентні електрони і перетворюються в позитивні заряджені іони. Відносно вільні електрони, що відірвалися від атома, переміщаються між позитивними іонами металів. Між ними виникає металевий зв'язок, т. е. Електрони як би цементують позитивні іони кристалічних ґраток металів.
Електрохімі́чний ряд напру́г, ряд активності — послідовність металів за ступенем легкості віддачі електронів при хімічних реакціях у водних розчинах солей.
У цьому ряді найпоширеніші метали розташовуються в такому порядку:
K, Na, Ba, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
Електрохімічний ряд напруг показує:
- Чим лівіше розміщений метал у ряді напруг, тим він
- хімічно активніший; - сильніший відновник; -легше окислюється
- важче відновлюється з його іонів
- Чим правіше розміщений метал в ряді напруг, тим він
- хімічно менш активний; -слабший відновник; -важче окислюється; - легше відновлюється з його іонів.
- Кожний метал ряду напруг відновлює (витісняє) катіони всіх металів, що стоять у ряді правіше від нього у водних розчинах їх солей.
- Усі метали, що стоять у ряді напруг лівіше від водню, відновлюють (витісняють) його іони у водних розчинах кислот (крім нітратної), а метали, що стоять правіше від нього, не відновлюють.
Білет № 25
1)Охарактеризуйте окисно-відновні реакції,їх типи.Визначення коефіцієнтів у рівняннях окисно-відновних реакцій методом електронного балансу.
О́кисно-відно́вна реа́кція — хімічна реакція, яка відбувається зі зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником та атомом-відновником.
Типи:
- міжмолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в різних молекулах, наприклад:
-внутрішньомолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в одній і тій ж самій молекулі, наприклад:
-репропорціонування (компропорціонування)
-диспропорціонування (самоокиснення-самовідновлення) - реакції, в яких атоми одного елементу перетворюються на речовину (речовини) зі змінною ступенів окиснення, наприклад:
Окисно-відновна реакція між воднем та фтором:
Поділяється на дві напівреакції:
1) Окиснення:
2) Відновлення:
Атоми та йони, які в даній реакції приєднують електрони є окисниками, а які віддають електрони -відновниками.
Метод електронного балансу – це один з методів зрівнювання окислювально-відновних реакцій(ОВР).Полягає в тому щоб на підставі мір окислення розставити коефіцієнти в ОВР.Для правильного зрівнювання слід дотримуватися певної послідовності дій:
Знайти окисник і відновник.
Скласти для них схеми(напівреакції) переходів електронів, що відповідають цьому окислювально-відновному процесу.
Зрівняти число відданих і прийнятих електронів в напівреакціях.
Підсумувати нарізно ліві і праві частини напівреакцій.
Розставити коефіцієнти в рівнянні окислювально відновної реакції.
Приклад: Li + N2 = Li3N
Li0 + N20 = Li3+1N−3
Li0 — 1e = Li+1
Отримуємо:
6Li0 — 6e = 6Li+1
N20 + 6e = 2N−320 + 6e = 2N−3
6Li + N2 = 2Li3N
2)Проаналізуйте поширення в природі,властивості,одержання і застосування лужних металів та їх сполук.
Лужні метали - це елементи 1-ї групи періодичної таблиці хімічних елементів (по застарілої класифікації - елементи головної підгрупи I групи): літій Li, натрій Na, калій K, рубідій Rb, цезій Cs і францій Fr. При розчиненні лужних металів в воді утворюються розчинні гідроксиди, звані лугами. Лужні метали зустрічаються в природі у формі сполук, що містять однозарядні катіони. Багато мінералів містять у своєму складі метали головної підгрупи I групи.
Фізичні властивості
Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі. Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються в атмосфері інертного газу або під шаром гасу)
Хімічні властивості:
- Взаємодія з водою:
- Взаємодія з киснем:
-реагують із неметалами: 2Na + S = Na2S
2K + Br2 = 2KBr
Отримання лужних металів:
-Для отримання лужних металів використовують в основному електроліз розплавів їх галогенідів, найчастіше - хлоридів, що утворюють природні мінерали:
-проводять електроліз розплавів їх гідроксидів:
-Лужний метал може бути відновлений з відповідного хлориду або броміду кальцієм, магнієм, кремнієм та ін восстановителями при нагріванні під вакуумом до 600-900 C:
Білет №26
1) Охарактеризуйте будову комплексних сполук.Типи хім..зв.в комплексних сполуках.
Комплексні сполуки – це стійкі хім.сполуки,у вузлах кристалічної гратки яких,містяться складні частинки,що містять центральний атом або йон і оточуючи його молекули або йони.
Будова КС: К3[Fe(CN)6]:зовнішня сфера,внутрішня сфера,ліганда,координаційне число,центральний атом(комплексоутворювач).В ролі комплексоутворювача виступають d – елементи.Координаційне число – це число зв’язків за допомогою яких,ліганди зв’язуються з комплексоутворювачем,воно залежить від природи комплексоутворювача і ліганд,із збільшенням ступеня окиснення центрального атома зростає і значення координаційного числа,яке переважно у 2 рази більше від валентності комплексоутворювача, і в більшості випадків має значення 2,4,6.Ліганди характеризує координаційна ємність або дентатність,що визначає кількість місць який займає ліганд у внутрішній координаційній сфері.
Природа хім.зв.в К.С.:
- Метод валентних зв’язків – пояснює утв.КС.за рахунок донорно-апцепторного зв’язку.Донором виступає атом,що входить до складу ліганда.
- Теорія кристалічного поля – пояснює властивості хім.сполук кристалічної будови,основана на тому,що між комплексоутворювачем і лігандами виникає електростатична взаємодія,як і при утворенні йонного зв’язку.
- Метод молекулярних орбіта лей,оснований на уявленні про утворення молекулярних орбіта лей,шляхом комбінації атомних орбіта лей комплексоутворювача і лігандів.
2) Проаналізуйте знаходження в природі,добування металів ІІ А групи.Добування.Солі Магнію та лужноземельних металів: властивості та використання їх в медицині.
……….
№27
2.Тве́рдість води́ — якщо вода містить значні кількості солей кальцію і магнію, то таку воду називають твердою, а коли цих солей зовсім немає, або вони містяться в незначних кількостях, то — м'якою.
Способи усунення твердості води
Для зниження твердості води застосовують різні способи. Серед них найбільш поширеним є так званий содово-вапняний спосіб. Суть його полягає в тому, що до води додають розраховану кількість розчину гідроксиду кальцію Са(ОН)2 (вапняна вода) і соди Na2CO3.
1. Ко́мплексні сполу́ки або координаці́йні сполу́ки — складні хімічні сполуки, в яких можна виділити центральнийатом (комплексоутворювач) і безпосередньо зв'язані з ним молекули або йони — так звані ліганди або аденти. Центральний атом та ліганди утворюють внутрішню сферу (комплекс); молекули або йони, які оточують комплекс — зовнішню координаційну сферу. Центральним атомом можуть бути як метали, так і неметали. Утворення комплексних сполук широко використовується в різноманітних галузях хімічної технології (виділення, очищення, розділення платинових, рідкісноземельних та деяких інших металів).
дисоціація комплексних сполук.
Особливість цього процесу обумовлена тим, що сфери комплексних сполук вкрай різняться між собою за ступенем стійкості елементів. Тут мається на увазі, перш за все, розбіжність зовнішньої і внутрішньої сфер речовини. Його частинки, які розташовуються у зовнішній сфері, дуже слабо пов'язані з комплексним іоном тому, що їх зв'язок забезпечується тільки за допомогою електростатичних сил. Як результат - вони абсолютно легко відчіплюються від основної речовини у водному розчині.
Така дисоціація комплексних сполук отримала назву первинної
Хімія — наука про речовини, їхні властивості, будову і взаємні перетворення.
Предмет вивчення хімії — хімічні елементи та їх сполуки, а також закономірності перебігу різних хімічних реакцій.
Приклади застосування хімії в різних галузя х:
— медицина — лікарські засоби та різні медичні матеріали;
— сільське господарство — добрива, засоби захисту рослин;
— харчова промисловість — барвники, ароматизатори, смакові добавки, синтезовані харчові продукти;
— металургія — процеси добування металів та їхніх сплавів;
— хімічна промисловість — хімічні реактиви, пластмаси, штучні тканини, барвники;
— будівництво — будівельні матеріали: цемент, шифер, цегла, оздоблювальні матеріали тощо.
Практично неможливо перелічити всі випадки використання хімічних знань, але є ще один важливий аспект їхнього застосування: без них неможливо зрозуміти сутність явищ і процесів, досліджуваних фізикою, біологією, геологією та іншими науками.
2. Хімія посідає важливе місце як в медицині, так і у фармації.
Хімія займає одне з провідних місць у розвитку фармації, адже без досягнень науки хімії було б неможливо виготовляти практично жодного лікарського препарату.
Зв’язок хімії з фармацією має давнє коріння. Так, у середні століття алхіміки неодноразово робили спроби втрутитися в медицину і часто лікар, і хімік сполучалися в одній особі. Проте алхімічні теорії не могли принести користі практичній медицині, тому що вони ґрунтувалися не на досвіді, а на упереджених і помилкових твердженнях і, як правило, вели до помилок.
Випадкові успіхи хіміків і використання народного досвіду все-таки допомагали медикам і первісним фармацевтам, і контакти між ними і хіміками ніколи не переривалися.
Наука хімія та хімічна промисловість сильно впливає на різноманітні сторони людської діяльності. Цей вплив відбувається і у напрямку фармації. Без сучасної хімії неможливо уявити розвиток сучасної галузі фармації. Хімію, без перебільшення, можна віднести до матері фармації.
2.Властивості елементів підгрупи Хрому
До побічної підгрупи шостої групи входять d-елемент и – Хром, Молібден та Вольфрам. Відповідні прості речовини являють Хром добувають методом алюмотермії або електролізом його солей:
Cr2O3 + 2Al 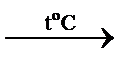 Аl2О3 + 2Сr.
Аl2О3 + 2Сr.
Молібден і вольфрам можна отримати відновленням їх оксидів вуглецем або воднем собою сірувато-білі, блискучі і дуже тугоплавкі метали.
Хром та його аналоги мають валентні електрони на s, d-підрівнях, в своїх сполуках можуть виявляти ступінь окисненн Хром (VI) оксид (хром ангідрид СrО3) з водою утворює хромову кислоту середньої сили.
Розчинними солями хромової кислоти є натрій, калій, магній та кальцій хромати, Хромати існують лише в лужному середовищі, в кислому вони переходять в дихромати:
2К2СrO4 + H2SO4 = К2Сr2O7 + K2SO4 + Н2О (в кислому середовищі);
К2Сr2О7 + 2КОН = 2К2СrO4 + Н2О(у лужному середовищі).
Хромати та дихромати є сильними окисниками, особливо в кислому середовищі:
K2Cr2O7 + 6KBr + 7H2SO4 = Cr2(SO4)3 + 3Br2 + 4K2SO4 + 7Н2О.
Сполуки хрому (III) в лужному середовищі виступають як відновники:
Cr2(SO4)3 + 3Br2 +16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8H2O.
Окиснення Cr (III) до Сr (VI) супроводжується заміною кольору від зеленого до жовтого.
За реакцієй: K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + Н2О
одержують хромо-калієві галуни (KCr(SO4)2 ×12Н2О).
Найважливішими є сполуки хрому з киснем — оксиди та відповідні їм гідроксиди і солі. Червоному моноксиду СrО і жовтому дигідроксиду Сr(ОН)2 відповідають волошкові солі типу СrС12∙4Н2O, СrSO4 ∙ 7Н2O — сильні відновники, а зеленому сесквіоксиду Сr2O3 i сіро-блакитному тригідроксиду Сr (ОН)3, що проявляє амфотерність, — фіолетові та зелені солі СrС13 ∙ 6Н2O, КСr (SО4)2 ∙ 12Н2O, Сr (NO3)3 ∙ 9Н2O та ін., які застосовують для синтезу ін. X. с, дублення шкір, як протраву при фарбуванні тканин тощо, а також хроміти типу Na3[Сr (ОН)6], МgСr2O4, YСrО3, з яких виготовляють каталізатори, електроди МГД-генераторів, нагрівачі електропечей і т. ін. Хроміт СuСr2O4 прискорює горіння твердого ракетного палива — пороху. Сr2O3 — сировина для добування металевого хрому, керамічних матеріалів] пігмент для фарфору і скла, полірувальний абразивний матеріал, каталізатор тощо. Чорний діоксид СrO2 використовують як феритний матеріал. Отруйні темно-червоні кристали СrO3 утворюють з водою хромові к-ти Н2СrO4, Н2Сr2O7 та ін. Застосовують СrO3 для електролітичного хромування, як енергійний окислювач, для синтезу хроматів. Відомо багато координаційних сполук хрому, напр. [Сr (СО)6], [Сr (С10Н8N2)2] СlO4.
БІЛЕТ № 29
1. Ізомерія комплексних сполук
Комплексним сполукам властива ізомерія. Найпоширеніші види ізомерії коротко схарактеризовано нижче.
Гідратна ізомерія полягає в різному розміщенні молекул води у внутрішній і зовнішній координаційних сферах. Наприклад, формулі СrСl3×6Н2О відповідають три комплексні сполуки: [Сr(Н2О)6]С13 — фіолетового кольору, [Сr(Н2О)5С1]С12×Н2О — світло-зеленого і [Сr(Н2О)4С12]С1×2Н2О — темно-зеленого кольору.
Іонізаційна ізомерія полягає в різному розміщенні іонів у внутрішній і зовнішній сферах. Наприклад, формулі Со(NН3)3Вr×SO4 відповідають дві комплексні сполуки: [Со(NН3)5Вr]SО4, з розчину якої легко осаджується ВаSО4 і важко — АgВr, і [Со(NH3)5SО4]Вr, з розчину якої, навпаки, легко oсаджується АgВr і важко — ВаSО4.
Координаційна ізомерія, за якої комплексоутворювачі немовби обмінюються лігандами:
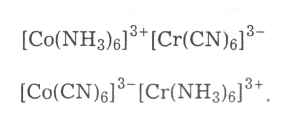
Ізомерія зв'язку. Деякі ліганди, наприклад іони СN-, NCS-, NO2-, мають по два донорні атоми і можуть координуватися різними способами, тобто є амбідентатними лігандами. Так, іон NO2- може координуватись як атомом Нітрогену, так і атомом Оксигену. У першому випадку утворюються нітрокомплекси [Co(NH3)5NO2]Br2, у другому — нітритокомплекс [Co(NH3)5ONO]Br2. Стійкішим у цьому є нітрокомплекс, нітритокомплекс мимовільно перетворюється на нітрокомплекс.
Геометрична ізомерія полягає в різному просторовому положенні лігандів відносно комплексоутворювача. Вона властива різнолігандним комплексним сполукам з квадратно-площинною або октаедричною (чи біпірамідальною) структурою, наприклад [Р1(NН3)2С12]
Оптична ізомерія характерна для різнолігандних або хелатних комплексних сполук, у цьому разі один ізомер є дзеркальним відбитком іншого. Оптичні ізомери утворюються одночасно в однакових кількостях і складають рацемічну суміш.
2.Загальна характеристика Стануму та Плюмбуму.Властивості олова і свинцю та їх сполуки. Застосування в медицині та біогенна роль.
Станум не належить до числа поширених металів, але воно легко виплавляється з руд і тому стало відомим людині у вигляді його сплавів з купрумом (бронзи) ще в глибоку давнину. Станум звичайно трапляється у вигляді кисневої сполуки SnO2 - каменю стануму, з якого і добувають його за допомогою відновлення вугіллям.
У вільному стані станум -- сріблястобілий м'який метал. При згинанні палички стануму чути характерний тріск, зумовлений тертям окремих кристалів між собою. Станум м'який, тягучий, його можна легко прокатати в тонкі листи, що називаються олов'яною фольгою або станіолем.
Крім звичайного білого стануму, що кристалізується в тетрагональній системі, існує друга видозміна стануму -- сірий станум --, що кристалізується в кубічній системі і має меншу густину. Біле станум стійке при температурах вище за 14° С, а сіре -- при температурах нижче за 14° С. Тому при охолодженні білий станум перетворюється в сірий. У зв'язку із значною зміною густини метал при цьому розсипається на сірий порошок. Це явище дістало назву олов' яної чуми. Найшвидше білий станум перетворюється в сірий при температурі близько --30° С; цей процес прискорюється при наявності зародків кристалів сірого стануму.
На повітрі станум при кімнатній температурі не окислюється, але нагріте вище від температури плавлення поступово перетворюється в діоксид стануму SnO2.
Вода не діє на станум. Розбавлені хлоридна і сульфатна кислоти діють на нього дуже повільно, що пояснюється великим перенапруженням виділення гідрогену на цьому металі. Концентровані розчини цих кислот, особливо при нагріванні, розчиняють станум. При цьому в хлорид ній кислоті утворюється хлорид стануму (ІІ), а в сірчаній -- сульфат стануму (IV):
Sn + 2НС1 = SnCl2 + H2 |
Sn + 4H2SO4 = Sn (SO4)2 + 2SO2 | + 4H2O.
З нітратною кислотою станум взаємодіє тим інтенсивніше, чим вищі концентрація кислоти і температура. В розбавленій кислоті утворюється розчинний нітрат стануму (ІІ):
4Sn + 10HNO3 = 4Sn (NO3)2 + NH4NO3 + 3H2O,
а в концентрованій -- сполуки стануму (IV), головним чином, нерозчинна ?-станатна кислота, склад якої приблизно відповідає формулі H2Sn03:
Sn + 4HNO3 = H2Sn031 + 4NO21 + H2O.
Концентровані луги також розчиняють станум. При цьому утворюються станіти -- солі станистої кислоти H2Sn02:
Sn + 2NaOH = Na2Sn02 + H21.
У розчинах станіти існують в гідратованих формах, утворюючи гідроксостаніти, наприклад:
Na2Sn02 + 2Н2О = Na2 [Sn (OH)4]
На повітрі стануму вкривається тонкою оксидною плівкою, що має захисну дію. Тому в умовах несильного корозійного впливу воно є хімічно стійким металом. Близько 40% всього стануму, яке виплавляють, витрачається на покриття ним виробів із заліза, які контактують з продуктами харчування, насамперед консервних банок. Це пояснюється зазначеною хімічною стійкістю стануму, а також тим, що його легко наносити на залізо і що продукти його корозії нешкідливі.
Станум утворює стійкі сполуки, у яких має ступінь окислення +2 і +4.
Сполуки стануму (II). Оксид стануму (II), або окис стануму, SnO -- темнобурий порошок, що утворюється при розкладанні гідроксиду стануму (II)Sn(OH)2 в атмосфері діоксиду карбону.
Гідроксид стануму (II) Sn (OH)2 утворюється у вигляді білого осаду при дії лугів на солі стануму (II):
Sn2+ + 2ОН- = Sn (OH) 2|
Гідроксид стануму (II) -- амфотерна сполука. Він легко розчиняється у кислотах і лугах, в останньому випадку з утворенням гідроксостанітів:
Sn (ОН)2 + 2NaOH = Na2 [Sn (ОН)4].
Хлорид стануму (II) SnCl2 * 2Н2О утворює безбарвні кристали. При нагріванні або значному розбавлянні розчину хлориду стануму (II) водою він частково гідролізується з утворенням осаду основної солі:
SnCl2 + Н2О = SnOHCl |+ НС1.
Хлорид стануму (II) -- відновник. Так, хлорид феруму (III) FeCl3 відновлюється ним у хлорид феруму (II) FeCl2:
2FeCl3 + SnCl2 == 2FeCl2 + SnCl4.
Сполуки стануму (IV). Діоксид (або двоокис) остануму SnO2 зустрічається в природі і його можна добути штучно спалюванням металу на повітрі або окисленням його нітратною кислотою з дальшим прожарюванням добутого продукту. Діоксид стануму застосовують для виготовлення білих полив та емалей.
Гідроксиди стануму (IV) називаються станатними кислотами.
Гідрид стануму SnH4 -- безбарвний, дуже отруйний газ. Він зріджується при --52° С, а при кімнатній температурі поступово розкладається на стануму і гідрогену.
Найважливіша руда, з якої добувають плюмбум, -- плюмбумний блиск PbS.
Перша металургійна операція при добуванні плюмбуму -- це випалювання, під час якого сульфід плюмбуму перетворюється в оксид:
PbS + ЗО2 = 2РЬ0 + 2SO2.
Плюмбум -- голубувато-білий важкий метал, дуже м'який -- його можна різати ножем.
Плюмбум широко використовують у техніці. Найбільше його витрачають на виготовлення оболонок кабелів та пластин акумуляторів. Плюмбум добре поглинає проміння.
Вода не взаємодіє з плюмбумом, але при наявності повітря плюмбум поступово руйнується водою з утворенням гідроксиду плюмбуму (II):
2РЬ + О2 + 2Н2О = 2РЬ (ОН)2.
Розбавлені хлоридна і сульфатна кислоти майже не діють на плюмбум. В концентрованій сульфатній кислоті, особливо при нагріванні, плюмбум інтенсивно розчиняється з утворенням розчинної кислої солі Pb (HSO4)2.
В нітратній кислоті плюмбум розчиняється легко, причому в кислоті невисокої концентрації швидше, ніж у концентрованій. Плюмбум порівняно легко розчиняється в оцтовій кислоті, що містить розчинений кисень.
У лугах плюмбум також розчиняється, хоч і повільно; Інтенсивніше він розчиняється в гарячих розбавлених розчинах.
Всі розчинні сполуки плюмбуму отруйні.
Для плюмбуму характерні ступені окислення +2 і +4. Значно стійкіші і численніші сполуки з ступенем окислення плюмбуму +2.
Сполуки плюмбуму (II). Оксид плюмбуму (II), або окис плюмбуму, РЬО -- жовтий порошок, що утворюється при нагріванні розплавленого плюмбуму на повітрі. Після прожарювання приблизно при 500° С він набуває червонувато-жовтого кольору і в такому вигляді називається глетом.
Оксид плюмбуму має різноманітне застосування: для заповнення комірок в акумуляторних пластинах, виготовлення деяких сортів скла; з нього добувають також інші сполуки плюмбуму.
Гідроксид плюмбуму (II) РЬ(ОН)2 утворюється при дії лугів на розчинні солі плюмбуму (II). Він має амфотерні властивості і розчиняється в кислотах з утворенням солей плюмбуму (II), а в лугах з утворенням гідроксоплюмбітів.
Хлорид плюмбуму (II) РЬС12 утворюється у вигляді білого осаду при дії на розчини солей плюмбуму (II) хлоридною кислотою або розчинними хлоридами. Хлорид плюмбуму мало розчиняється у холодній воді, але при підвищенні температури його розчинність у воді дуже зростає.
Ацетат плюмбуму (II) РЬ (СН3СОО)2 -- одна з не багатьох добре розчинних солей плюмбуму, що широко застосовується в лабораторній практиці. Ацетат плюмбуму солодкий на смак, і тому його ще називають плюмбумним цукром. Його застосовують у процесі фарбування тканин, а також для добування інших сполук плюмбуму.
Сульфат плюмбуму (II) PbSO4 випадає у вигляді білого осаду, якщо добавляти сульфатну кислоту або розчинні сульфати до розчинів солей плюмбуму (II). У воді і в розбавлених кислотах сульфат плюмбуму майже не розчиняється, але досить легко розчиняється в концентрованих розчинах лугів з утворенням плюмбітів. Концентрована сульфатна кислота також розчиняє сульфат плюмбуму, перетворюючи його у кислу сіль Pb (HSO4)2.
Всі сполуки плюмбуму (IV) -- дуже сильні окислювачі.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3162; Нарушение авторских прав?; Мы поможем в написании вашей работы!