
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Н.В. Кабак
|
|
|
|
Олово
Станум (Sn) — хімічний елемент з атомним номером 50 та атомною масою 118,69, що утворює просту речовину, метал олово. Олово має сріблясто-білий колір і володіє хорошою пластичністю, на повітрі поступово покривається захисним окисним шаром. При згоранні утворюється білий порошок - окисел олова SnO2, використовуваний як поліруючий засіб. Соляна і сірчана кислоти діють на олово дуже поволі. Розчиняючись в соляній кислоті, олово утворює хлорид SnCl2при взаємодії його з концентрірованной азотною кислотою утворюється олов′яна кислота H2SnO3 - сірий порошок, розчинний в розведеній азотній кислоті:
Sn + 2HCl = SnCl2 + H2
Sn + 4H2SO4 = Sn(SO4)+ 2SO2 + 4H2O
Sn + 4HNO3 = H2SnO3 + 4NO2 + H2O.
В сильних лугах олово поволі розчиняється, при цьому виділяється водень і утворюються солі:
Sn + 2NaOH = Na2SnO2 + H2.
Дісульфід олова SnS2 застосовують як фарбу золотистого кольору під назвою «сухозлітне золото» для позолоти дерева, діоксид SnO2 йде на приготування жаростійких емалей і свинцевий-олов′яних. В медицині застосовують PbO для виготовлення свинцевого пластиря, який застосовують при гнійно-запальних захворюваннях шкіри, фурункулах і т.д. крім того, PbO застосовується в розчинах при опіках, екземах.
Ацетат свинцю (ІІ) і ацетат свинцю основний застосовують як в’яжучий засіб при запальних захворюваннях шкіри і слизових оболонок. “
Свинець його властивості і сплави
Свинець - голубувато-білий важкий метал з металевим блиском в свіжому зрізі. Синюватий колір і металевий блиск на повітрі швидко зникають через те, що свинець покривається шаром окислу і солей, що виходять при доступі вологи і кислот повітря. М’якість свинцю виявляється в тому, що він ріжеться ножем, що пише, залишаючи сіру межу. Пари і багато з’єднань свинцю отруйні. Для виявлення свинцю і його з’єднань використовується сірководень. При взаємодії свинцю з сірководнем утворюється чорний осад сульфіду свинцю:
PbCl2 + H2S = PBS + 2HCl
Pb(NO3) 2 + H2S = PBS + 2HNO3.
Свинець широко використовується в техніці. Він входить до складу багатьох сплавів.Використовують його також для споруд, що захищають від радіоактивних випромінювань.
Широкого застосування в медицині свинець не отримав через свою високу токсичність. Використовується тільки Pb (CH 3 COO) 2 3H 2 O, або свинцева вода, для примочок від саден. Важкий свинець добре затримує згубні для людини випромінювання і тому свинцеві екрани використовуються для захисту працівників рентгенівських кабінетів, у свинцевих контейнерах зберігають і перевозять радіоактивні препарати.
БІЛЕТ №30
1 Загальна характеристика галогенів
Галогени - головна підгрупа VII групи, до якої включені Флуор, Хлор, Бром, Йод, Астат. На зовнішньому електронному рівні атоми галогенів містять 7 електронів (nS2 nP5).
Зі збільшенням порядкового номера в ряду F - At збільшуються радіуси атомів, зменшуються електронегативність, неметалічні властивості і окиснювальна здатність елементів.
Флуор у всіх своїх сполуках проявляє ступінь окиснення -1, інші галогени можуть мати ступінь окиснення від -1 до +7. Зв’язок у молекулі – F – F більш слабкий, ніж у молекулах Cl – Cl або Br – Br, тому флуор є хімічно більш активним.
Властивості елементів підгрупи Хрому
До побічної підгрупи шостої групи входять d-елементи – Хром, Молібден та Вольфрам. Відповідні прості речовини являють Хром добувають методом алюмотермії або електролізом його солей:
Cr2O3 + 2Al 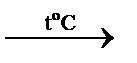 Аl2О3 + 2Сr.
Аl2О3 + 2Сr.
Молібден і вольфрам можна отримати відновленням їх оксидів вуглецем або воднем собою сірувато-білі, блискучі і дуже тугоплавкі метали.
Хром та його аналоги мають валентні електрони на s, d-підрівнях, в своїх сполуках можуть виявляти ступінь окисненн Хром (VI) оксид (хром ангідрид СrО3) з водою утворює хромову кислоту середньої сили. Молібден оксид (VI) та вольфрам оксид (VI) (МоО3 та WO3) у воді погано розчинні, але розчиняються в лугах, утворюючи солі молібденової та вольфрамової кислот:
МоО3 + 2NaOH = Na2MoO4 + Н2О.
Молібденову та вольфрамову кислоти одержують дією сильних кислот на відповідні солі:
Na2WO4 + 2HNO3 =H2WO4 + 2NaNO3.
Розчинними солями хромової кислоти є натрій, калій, магній та кальцій хромати, а молібденової та вольфрамової кислоти - лише натрій і калій молібдати та вольфрамати.
Хромати існують лише в лужному середовищі, в кислому вони переходять в дихромати:
2К2СrO4 + H2SO4 = К2Сr2O7 + K2SO4 + Н2О (в кислому середовищі);
К2Сr2О7 + 2КОН = 2К2СrO4 + Н2О(у лужному середовищі).
Хромати та дихромати є сильними окисниками, особливо в кислому середовищі:
K2Cr2O7 + 6KBr + 7H2SO4 = Cr2(SO4)3 + 3Br2 + 4K2SO4 + 7Н2О.
Сполуки хрому (III) в лужному середовищі виступають як відновники:
Cr2(SO4)3 + 3Br2 +16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 +
+ 8H2O.
Окиснення Cr (III) до Сr (VI) супроводжується заміною кольору від зеленого до жовтого.
За реакцієй:
K2Cr2O7 + 3SO2 + H2SO4 = Cr2(SO4)3 + K2SO4 + Н2О
одержують хромо-калієві галуни (KCr(SO4)2 ×12Н2О).
Хрому оксиди, хрому оксиди, з'єднання хрому з кисня: CRO, Cr 2 O 3, Cro 2, Cro 3 і ін.
Хрому закис, CRO, чорні кристали. Нерозчинна у воді и гарячих концентрованіх Hcl и H 2 So 4. Сильний відновнік. Cr 2 O 3, темно-Зелені кристали. У воді нерозчинна. Хрому двоокіс, Cro 2, кристали чорного кольори.
Хрому тріокіс, хромової ангідрід, Cro 3, темно-червоні кристали. Гігроскопічна, розпливається на повітрі. З водою утворює хромові кислоти. Сильний окислювач. Отримуються дією H 2 So 4 на дихромат натрію Na 2 Cr 2 O 7 (Рідше K 2 Cr 2 P 7).. хрому тріокіс, так само Як и ін. з'єднання Cr (VI), отруйна.
ром та його аналоги широко використовують як легуючі додатки до спеціальних нержавіючих сталей, які містять більш 10% Хрому. При меншому вмісті Хрому сталь набуває значної міцності та твердості. Сплав нікелю з хромом ніхром (80% Ni, 20% Cr) має високу температуру плавлення, його використовують в нагрівальних елементах печей, які дають можливість досягти температури +1100 °C.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 433; Нарушение авторских прав?; Мы поможем в написании вашей работы!