
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічний зв‘язок
|
|
|
|
Хімічний зв‘язок здійснюється спільною електронною парою, яка утворюється неспареними електронами взаємодіючих атомів.
Умовою виникнення хімічного зв‘язку є наявність у цих електронів антипаралельних спінів, тобто значень спінових квантових чисел ms з протилежним знаком, а саме 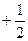 та
та  .
.
Наприклад, неспарені s-електрони двох атомів гідрогену з антипаралельними спінами утворюють спільну електронну пару, тобто між атомами гідрогену виникає хімічний зв‘язок. Відстань між ядрами атомів в молекулі водню Н2 (r) є меншою, ніж подвоєний радіус атомів гідрогену (2r0).
H + H = H↑↓H
1s↑ 1s↓
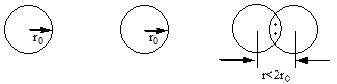
Це свідчить про те, що, завдяки притяганню електронів одночасно до обох ядер взаємодіючих атомів, відбувається перекривання їх електронних хмар. В міжядерному просторі з’являється ділянка з підвищеною електронною густиною, тобто ділянка з підвищеною густиною негативного заряду, яка скріплює між собою позитивно заряджені ядра взаємодіючих атомів.
Для того, щоб визначити тип хімічного зв’язку, потрібно порівняти електронегативність елементів, між атомами яких виникає хімічний зв‘язок.
Електронегативність χ елемента характеризує здатність атомів елемента під час утворення хімічного зв‘язку притягувати до себе спільну електронну пару порівняно з атомами інших елементів.
Електронегативність елемента враховує і здатність його атомів віддавати електрони, характеристикою якої є енергія іонізації I, і здатність атомів приєднувати електрони, характеристикою якої є спорідненість до електрона Е. Електронегативність елемента дорівнює напівсумі енергії іонізації атомів та спорідненості атомів до електрона і вимірюється у кДж/моль:
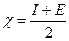
На практиці користуються значеннями відносної електронегативності елементів. Електронегативність літію приймають за одиницю і порівнюють з нею електронегативності інших елементів. Величини відносної електронегативності елементів знаходяться в інтервалі значень від 0,7 до 4.
В періоді зі збільшенням заряда атомних ядер елементів здатність його атомів притягувати до себе електрони збільшується, отже, і електронегативність елементів зростає. В головних підгрупах у вказаному нижче стрілкою напрямку радіуси атомів збільшуються, тому здатність атомів притягувати до себе електрони послаблюється і електронегативність елементів зменшується.
Період: заряд ядра збільшується, χ зростає
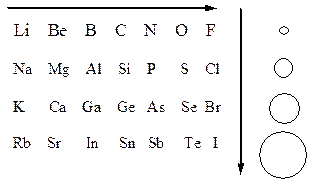
В головних підгрупах:
радіус атомів збільшується,
χ зменшується.
Отже, флуор має найбільше значення електронегативності, тобто є найбільш електронегативним елементом. Найменші значення електронегативності у лужних металів.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 419; Нарушение авторских прав?; Мы поможем в написании вашей работы!